ER/ES実践について研究するページです。…
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
電子化に関する関連法令
1. はじめに
製薬企業ではともすると「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」(以下、「ERESガイドライン」)のみを対象とし、社内における電磁的記録や電子署名の対処方法を検討しがちである。
しかしながら、前号でも紹介したとおり、いわゆる「電子署名法」「e-文書法」「厚生労働省令第44号」等に関しても注意を払う必要がある。
これらは法令であるので、指針にもまして遵守が求められるからである。
しかしながら関連する法令をすべて理解することは容易ではなく、また対応のために検討すべき課題も多くある。
本稿では、関連法令とそれらが製薬業界に及ぼす影響と課題を整理してみたい。
2. 電子署名法とは
「電子署名及び認証業務に関する法律」(平成12年5月31日法律第102号)は、電子署名とその認証に関する規定を定め、電子署名が手書き署名や押印同様に通用する法的基盤を整備することで、情報流通の円滑化を図った法律である。2001年4月から施行された。
| 第一条(目的) 第二条(定義) この法律において「電子署名」とは、電磁的記録(電子的方式、磁気的方式その他人の知覚によっては認識することができない方式で作られる記録であって、電子計算機による情報処理の用に供されるものをいう。以下同じ。)に記録することができる情報について行われる措置であって、次の要件のいずれにも該当するものをいう。 一 当該情報が当該措置を行った者の作成に係るものであることを示すためのものであること。 二 当該情報について改変が行われていないかどうかを確認することができるものであること。 第三条 電磁的記録の真正な成立の推定 第四~十六条 特定認証業務の認定等 第十七~三十二条 指定調査機関等 第三十三~四十条 雑則 第四十一~四十七条 罰則 附則 |
図1 電子署名法(要約)
第2条では、まず「電子署名」の定義として、下記の通り記載されている。
「電磁的記録に記録することができる情報について行われる措置であって、次の要件のいずれにも該当するものをいう。
1. 当該情報が当該措置を行った者の作成に係るものであることを示すためのものであること。
2. 当該情報について改変が行われていないかどうかを確認することができるものであること。」
1.は「本人性の証明」を求めており、2.では「非改ざん証明」を求めている。
電子署名法では、この「本人性の証明」と「非改ざん証明」をともに満たすものを電子署名としていることに注意が必要である。
また「認証業務」に関しては、電子署名の利用者の証明を行う業務のこととある。
さらに法的に有効な電子署名の認証は「特定認証業務」と呼ばれ、一定の条件を満たして国から認定を与えられた事業者(認証局)によって行なわれるものと規定されている。
つまり電子署名法を理解する上で重要なことは、電子署名法における電子署名は、認証局の認証を伴うものでなければならないということである。
第3条には「電磁的記録の真正な成立の推定」が規定されている。「電磁的記録であって情報を表すために作成されたものは、当該電磁的記録に記録された情報について本人による電子署名が行われているときは、真正に成立したものと推定する。」とある。
また推定を受ける電子署名は、「これを行うために必要な符号及び物件を適正に管理することにより、本人だけが行うことができることとなるものに限る。」とある。
このように、電子署名法による電子署名の要件として、「本人性の証明」「非改ざん証明」「認証局による認証」といった3つの要件がある。
筆者の知る限り、これらすべての要件を満たす技術は、デジタル署名しかないと理解している。
しかしながら、製薬企業などで資料等を電子化し電子署名を付す場合(例としてEDCにおける電子CRFがあげられる)、デジタル署名の利用には以下のような課題と問題点がある。
- デジタル署名のデファクトスタンダードがない。
つまり国際的に通用するデジタル署名が存在しない。
グローバル治験などで、日本の認証局が認証したデジタル署名を欧米の当局が許容するかどうかは不明である。 - 電子証明書には有効期限がある。
長期保存を行わなければならない資料にデジタル署名を付さなければならない場合、保存期間中に電子証明書の有効期限が切れてしまう。証明書の有効期限が切れた場合、電子署名(デジタル署名)が付加されていても、それが有効期限内に署名されたものか、有効期限が切れてから署名されたものか不明となってしまう。 - デジタル署名のマイグレーション デジタル署名も技術のひとつであるため、経時的に改良が加えられる可能性がある。従って、長期保存中にマイグレーションが必要になる可能性がある。
このように長期保存を行わなければならない電子文書には、デジタル署名の利用は向かないと言える。
ERESガイドラインでは、電子署名は電子署名法に基づき、電子署名の管理・運用に係る手順が文書化されており、適切に実施しなければならないこととなっている。
しかしながら、米国においては21 CFR Part 11で電子署名法とは違った電子署名が定義されており、米国が先行するEDCシステムでは、もっぱらその定義による電子署名が使用されている。
グローバル治験においては、日本でも共通の定義を行わなければならないことになる。
なお欧米の規制当局と業界では、SAFE(Signatures and Authentication For Everyone)と呼ばれる電子署名の方式が検討され利用を開始しているところである。残念ながら日本ではこのSAFEは、あまり知られていない。
3. e-文書法とは
「民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律」(平成16年法律第149号)は、2005年4月から施行された。電磁的記録による「保存」「作成」「縦覧」「交付」について規定している。
この法律により、電子文書がこれまでの「共有情報」という位置付けから「裁判で使える証拠」とできるようになった。
民間への紙による文書保存義務について、医療機関のカルテなど、原則全て電子保存を容認(運転免許証、損益計算書や貸借対照表、高額の領収書などは除く)している。
画期的なことは、電子署名法では初めから電子文書として作成された文書(電子文書)を対象としていたのに対し、e-文書法では、紙の文書をスキャナで読み取った画像データも一定の技術要件を満たせば原本と見なすことを認めたことである。
| 第一条(目的) 第二条(定義) 【書面】書面、書類、文書、謄本、抄本、正本、副本、複本その他文字、図形等人の知覚によって 認識することができる情報が記載された紙その他の有体物をいう。 【電磁的記録】電子的方式、磁気的方式その他人の知覚によっては認識することができない方式で 作られる記録であって、電子計算機による情報処理の用に供されるものをいう。 【保存】書面又は電磁的記録を保存し、保管し、管理し、備え、備え置き、備え付け、 又は常備することをいう。 【作成】書面又は電磁的記録を作成し、記載し、記録し、又は調製することをいう。 第三条(電磁的記録による保存) 保存のうち当該保存に関する他の法令の規定により書面により行わなければならないとされているもの (主務省令で定めるものに限る。)については、当該法令の規定にかかわらず、主務省令で定めるところにより、 書面の保存に代えて当該書面に係る電磁的記録の保存を行うことができる。 第四条(電磁的記録による作成) 作成のうち当該作成に関する他の法令の規定により書面により行わなければならないとされているもの (当該作成に係る書面又はその原本、謄本、抄本若しくは写しが法令の規定により保存をしなければならない とされているものであって、主務省令で定めるものに限る。)については、当該他の法令の規定にかかわらず、 主務省令で定めるところにより、書面の作成に代えて当該書面に係る電磁的記録の作成を行うことができる。 第五条(電磁的記録による縦覧等) 第六条(電磁的記録による交付等) 第七条(条例等に基づく書面の保存等に係る情報通信の技術の利用の推進等) 第八条(政令又は主務省令の制定改廃に伴う経過措置) 第九条(主務省令) この法律における主務省令は、当該保存等について規定する法令を所管する内閣府又は各省の内閣府令 又は省令とする。 附則 |
図2 e-文書法(要約)
第2条では、定義が記載されている。
e-文書法において「書面」とは、紙媒体等の文書のことをいう。
これに対して「電磁的記録」とは、電子的な文書のことをいう。
また「保存」とは、「書面」や「電磁的記録」(つまり紙媒体や電子文書)を維持している状態をいう。
さらに「作成」とは、「書面」又は「電磁的記録」を記録したり記載したりすることをいう。
第3条では、主務省令が定める書面に限って、電磁的記録による保存を認めるとある。電磁的記録による保存の場合、その多くは書面のイメージ(スキャナで読み込んだ画像や帳票をpdfに出力したもの)のままではなく、リレーショナルデータベースなどにデータが分散されて保持されている。要事には、当該記録を読み出すソフトウェアによって画面に出力したり、印刷することになる。
第4条では、主務省令が定める書面に限って、電磁的記録による作成を認めるとある。主務省令が認めないものにおいては、書面(つまり紙媒体等)に記録・記載しなければならないことになる。この場合でも、主務省令が電磁的記録による保存を認めている場合、スキャナにより電子化し、保存することは可能となる。
さらに、第4条の3項には、「当該作成に関する他の法令の規定により署名等をしなければならないとされているものについては、当該法令の規定にかかわらず、氏名又は名称を明らかにする措置であって主務省令で定めるものをもって当該署名等に代えることができる。」とある。
4. 厚生労働省令第44号とは
e-文書法の規定に基づき、厚生労働省は、平成17年3月25日に「厚生労働省の所管する法令の規定に基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省令」(厚生労働省令第44号)を発令した。
電磁的記録による保存における課題として「見読性」「完全性」「機密性」「検索性」などの確保が挙げられるが、e-文書法が対象とする文書にはさまざまなものが含まれ、それぞれ内容・性格が異なるため、見読性や完全性などを確保するための要件は必ずしも共通しない。
それらの要件の対応方法は、対象文書によって大きく異なるため、電磁的記録による保存の具体的な方法や要件については、e-文書法では規定せず、文書内容の重要性や消失・改ざん・漏えいなどが発生した場合の影響の大きさなどによって、各省庁が省令によって定めている。
この省令は、厚生労働省の所管する法令に係る保存等を、電磁的記録を使用して行う場合に適用され、電磁的記録により保存できる書面を定義している。
| 第一条(趣旨) 保存等を電磁的記録で行う場合の定め 第二条(定義) 用語の定義はe-文書法による 第三条(e-文書法 第三条第一項の主務省令で定める保存) e-文書法 第三条第一項の主務省令で定める保存は、別表第一の一から三までの表の上欄に掲げる法令の 同表の下欄に掲げる書面の保存とする。 GxP関連は別表第一の一に記載がある。 第四条(電磁的記録による保存) 保存方法には、磁気ディスク等による「電子ファイル」(当初から電子で作成したもの)およびスキャナで 読み取った「画像ファイル」の2通りがある。 「見読性」「真正性」「保存性」を確保すること。 別表第一の一に掲げる書面(GxP)は、「見読性」の確保のみ要求。 第五条(法第四条第一項の主務省令で定める作成) e-文書法 第四条第一項の主務省令で定める作成は、別表第二の上欄に掲げる法令の同表の下欄に掲げる 書面の作成とする。 第六条(電磁的記録による作成) 電磁的記録の作成は、「電子ファイル」方式で行う。書面をスキャナで読み取り「画像ファイル」にする作業は 作成とは呼ばない。 第七条(作成において氏名等を明らかにする措置) e-文書法 第四条第三項に規定する主務省令で定める記名押印に代わるものは、電子署名(電子署名法 第二条第一項の電子署名をいう)とする。 第八条(法第五条第一項の主務省令で定める縦覧等) e-文書法 第五条第一項の主務省令で定める縦覧等は、別表第三の上欄に掲げる法令の同表の下欄に掲げる 書面の縦覧等とする。 第九条(電磁的記録による縦覧等) 第十条(法第六条第一項の主務省令で定める交付等) e-文書法 第六条第一項の主務省令で定める交付等は、別表第四の上欄に掲げる法令の同表の下欄に掲げる 書面の交付等とする。 第十一条(電磁的記録による交付等) 第十三条(監事の意見書) 附則 |
図3 厚生労働省令第44号(要約)
第2条では、定義はe-文書法によるものとある。
第3条では、e-文書法 第3条第1項の規定にともない、厚生労働省で所管する書面に関して、電磁的記録により保存できるものは別表第1の1から3までに記載されたものを対象とすることとしている。
GxP省令関連は別表第1の1に記載がある。(図4参照)
| 治験に関する記録(文書及びデータを含む。)治験実施計画書、契約書、総括報告書その他この省令の規定により治験依頼者が作成した文書又はその写し症例報告書、通知文書、医療機関の長又は治験責任医師等から入手した記録モニタリング、監査、治験の依頼及び管理に係る業務の記録治験を行うことにより得られたデータ治験薬に関する記録(安定性等の品質に関する試験の記録、交付・回収の記録、処分の記録) |
図4 厚生労働省令第44号 別表第1の1(GPC省令関連のみ要約)
ここに記載されていない書面は、電磁的記録による保存ができないことになる。
GCP省令関連の書面はすべて電磁的記録により保存することが可能である。
GMP省令関連では、文書は電磁的に保存できるが、記録は電磁的に保存できないので注意が必要である。
第4条では、法令により定められた書面を電磁的記録による保存するには、以下の2つの方法があることが記載されている。
- 最初から電磁的記録により作成する場合(電子ファイル)
- 紙の書面をスキャナにより読み取った場合(画像ファイル)
本省令では、スキャナで取り込んだ書面に電子署名を付す事を求めていない。またスキャナの解像度や保存する画像ファイルの要件などに関する規定はない。
また保存した電磁的記録は「見読性」「真正性」「保存性」を確保することを要求している。
ただし、別表第1の1に掲げる書面(GxP省令関連が)は、「見読性」の確保のみ要求されている。なぜ「真正性」および「保存性」の要件をあえて外しているのかは、筆者にも不明である。
第5条では、e-文書法 第4条第1項の規定にともない、厚生労働省で所管する書面に関して、電磁的記録により作成できるものは別表第2に記載されたものを対象とすることとしている。(図5参照)
| 手順書の作成治験実施計画書、治験薬概要書の作成、記載、改訂治験薬の溶解方法その他の取扱方法に関する説明文書の作成文書による契約治験調整医師又は治験調整委員会委嘱に関する文書の作成監査証明書の作成(監査報告書は電磁的記録による作成から除外)総括報告書の作成治験審査委員会に関する手順書及び委員名簿の作成症例報告書の作成、変更に係る記載、点検に係る記載同意文書の記載、改訂、文書による記録 |
図5 厚生労働省令第44号 別表第2(GPC省令関連のみ要約)
一部電子的に保存しても良いが、電子的に作成できない書面もあるので注意が必要である。
例えばGCP省令における「監査報告書」や「モニタリング報告書」などである。
第6条では、電磁的記録による作成は、第4条で記載された2つの方法のうち、
1)最初から電磁的記録により作成する場合(電子ファイル)
のみとしている。
書面をスキャナで読み取り「画像ファイル」にする作業は作成とは呼ばない。この場合あくまでも作成は紙媒体等で既に行われているのである。
ここで書面の作成に代えて当該書面に係る電磁的記録の作成を行う場合は、電子計算機に備えられた「ファイルに記録する方法」又は「磁気ディスク等をもって調製する方法」により作成を行わなければならないとしている。(図6参照)
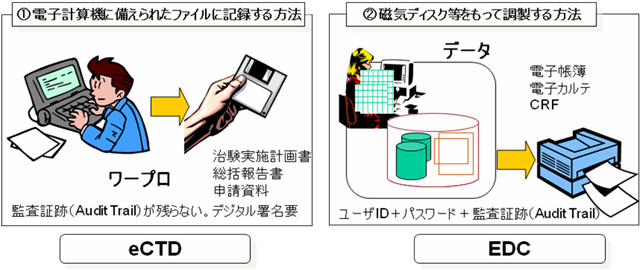
図6 「ファイルに記録する方法」と「磁気ディスク等をもって調製する方法」
「ファイルに記録する方法」では、ワープロなどにより文書を電子作成しておき、当該電子計算機に備え付けられた磁気ディスクまたは電磁的記録媒体(CD-R等)に保存しておくことになる。臨床試験において、治験実施計画書や総括報告書を作成することに相当する。
当該電磁的記録を電磁的記録媒体やネットワーク等を用いて、他のシステムへ受け渡す場合、ERESガイドラインや21 CFR Part 11の規定に従って、当該電磁的記録(電子ファイル)が作成されてから受け取られるまでの真正性を確保するため、デジタル署名等を付しておかなければならない。これはいわゆるオープンシステムと呼ばれる。
「磁気ディスク等をもって調製する方法」では、EDCシステムに代表されるように、当該書面に係る電磁的記録をリレーショナルデータベースに記録する方法をいう。この場合、個々の記録は時系列的に記録され、要時において必要とする記録の全部または一部を書面の形式としてディスプレイに表示したり、紙媒体に印刷したりすることとなる。
個々の記録は、患者の来院などに合わせて、遅滞なく入力されなければならない。その際に、ユーザIDとパスワードなどを用いて、適切な者のみが入力できるよう権限設定が行えなければならない。
また一旦確定された個々の記録は、その改ざんから守るため、監査証跡が自動的に記録されなければならない。
第7条では、法令の規定により、作成において氏名等を明らかにする措置を行う場合は、書面の場合の記名押印に代わって電子署名を使用することとしている。この場合の電子署名は電子署名法が規定しているものをいう。
書面における押印の場合、いわゆる三文判が多く用いられている。これは実印とは違って、役所による印鑑登録証を伴わないものである。しかしながら前述したとおり、電子署名法が規定する電子署名は、特定認証局の認証を伴うものでなければならない。これはいわば実印に相当するものである。
5. 電磁的記録による保存と作成の課題
電磁的記録による書面の保存には、考慮すべきいくつかの課題がある。
前章で解説したとおり、EDCシステムに代表されるように、電磁的記録を作成する際に「磁気ディスク等をもって調製する方法」を用いる場合、どの時点をもって電磁的記録が保存されたとするかは、当該システム毎にあらかじめ規定しておく必要がある。
例えば、入力途中で作業を一旦中断し、しばらく経ってから入力を再開する場合、システム的には一旦情報を保存したこととなる。しかしながら、再開後の入力に関して保存された記録の変更とみなして監査証跡を記録することは適切ではない。
この場合、保存は何らかの確定といった作業を伴うものとするべきである。
また例えば電子CRFが完成した(つまり責任医師が治験依頼者に提出する)際は、省令に従い記名押印に代わって電子署名を付さなければならない。
EDCシステムを利用し、電子CRF(原本)の保存を行う場合は、電子署名は当該システムが持つ機能を利用することとなる。またその真正性はセキュリティ、監査証跡、バックアップなどによって確保されているはずである。
しかしながら、当該EDCシステムから電子CRF(原本)を他のシステムや電磁的記録媒体に移す場合は、やはりデジタル署名(電子署名法に基づく電子署名)を付さなければならない。
しかしながら前述したとおり、デジタル署名は実用的とはいえない。
そのため日本製薬工業協会 医薬品評価委員会は「臨床試験データの電子的取得に関するガイダンス」の中で、デジタル署名に相当する電子CRF(原本)の信頼性を確保する要件をまとめたと理解している。
6. おわりに
本稿では、電子化に関する関連法令とその対応課題を整理した。
筆者も経験したが、法律の解釈は難しい。一般的に慣用されている用語とは定義が異なることも多々あり、既成観念を排除しながら理解することに苦労した。
次回はもう読者にはおなじみと思うが、今回の電子化に関する関連法令の知識を持った上で、ERESガイドラインについて再度解説してみたい。
参考
- 「電子署名及び認証業務に関する法律」平成12年5月31日 法律第102号
- 「民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律」平成16年 法律第149号
- 「厚生労働省の所管する法令の規定に基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省令」平成17年3月25日 厚生労働省令第44号
- 「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」平成17年4月1日 薬食発第0401022号
- 「Title 21 of the Code of Federal Regulations Part 11,“Electronic Records; Electronic Signatures”」 FDA 1997.3.20
- 「臨床試験データの電子的取得に関するガイダンス」 平成19年11月1日 日本製薬工業協会 医薬品評価委員会



Comment