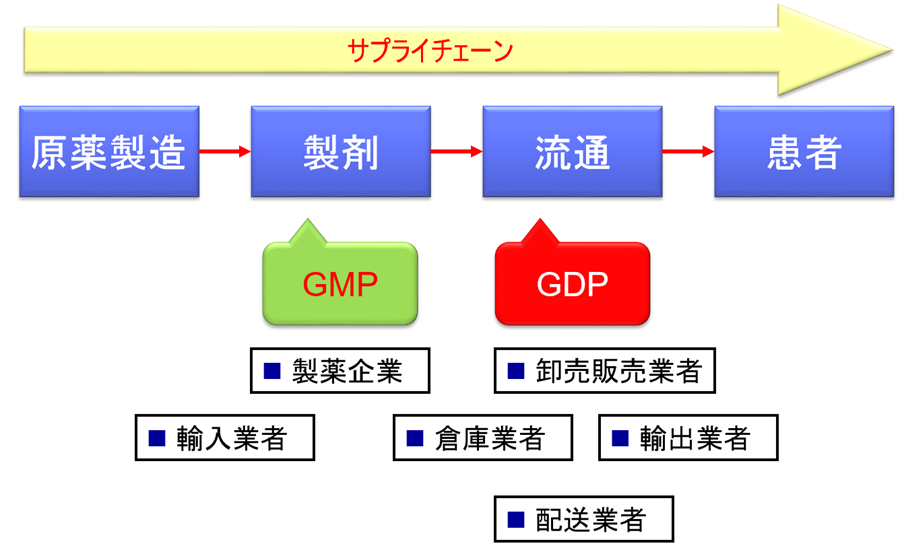
GDP:Good Distribution Practice(実践流通規範)は、輸送・保管過程における医薬品の品質を確保することを目的とした基準(適正な物流に関する基準)のことである。…
これまでは医薬品の品質に関してはGMPのみが運用されてきた。
しかしながら、出荷判定後、医薬品に対する品質確認が実施されていない。
本来製薬企業の使命として、製造したままの品質で患者に医薬品を供給する必要がある。
流通過程では、患者に医薬品が届くまで多くの業者や人が関与している、つまり、GMPだけでは品質保証は困難なのである。
医薬品は輸送・保管の過程で主に温度の変動により変質する可能性がある。
そこで、物流過程には様々な問題があり、医薬品の品質を維持する為には、適正に管理することが、重要になってきている。
しかしながら、医薬品は航空輸送、海上輸送、陸 運、各国の保税倉庫など、生産地から末端の患者まで多くの組織が関わる。
また医薬品は輸送・保管の過程で、主に温度の変動により変質する可能性がある。
医薬品によっては温度管理範囲を逸脱すると変質により使用不可になるものがある。(温度感受性、厳格な温度管理)
特に夏季配送時における積み下ろし時の温度上昇の影響などが懸念される。
GDPとは、製造業者から薬局、または医薬品を公共に供給する承認(資格)を有している個人に至るまでのサプライチェーン全段階で医薬品の品質が維持されることを保証する実践規範のことであり、医薬品品質保証の一環である。
現状では各国ごとに医薬品の流通に関する事情が異なり、GDPは各国間で整合していない。
30ヶ国以上がGDPを採択している。
- WHO:WHO Good Distribution Practice for Human Use
- 米国:Good Storage & Shipping Practices(GSP)
- EU:Guideline on Good Distribution Practice for Human Use
- 英国:Good Distribution Practice ( GDP)
- オーストラリア:Good Wholesaling Practice(GWP)
- 中国:Good Supply Practice (GSP)
- 日本:JGSP(Japanese Good Supplying Practice)
PIC/Sにおいても、『PIC/S Guide to Good Distribution Practice (GDP) for Medicinal Products』が2014年6月1日から施行されている。
主に、医科向け医薬品(処方箋薬)、OTC薬、麻薬、向精神薬が対象であるが、国によっては、原料、出発物質、原薬、添加物、動物薬、医療機器などを含む場合がある。
通常、医薬品を扱う輸送業者は専用の車両で厳密な温度管理を行ない、輸送中温度の記録を行っている。
例えば、オーストラリアから日本へ輸出するような場合、赤道をまたいで季節が冬から夏に逆転する。
そのような急激な温度変化に対して十分な対策をとらなければならない。
温度以外にも、湿度、振動、光などのハザード(危険の源)が存在する。
流通に関わる要員はあらかじめ特定することはできない、例えば輸送トラックの運転手などである。
また輸送経路も特定できない、また空港において1日留め置かれるケースなども可能性がある。
したがって、製薬企業内での品質管理のようにあらかじめ流通過程をバリデーションしておくことは困難である。
GDPにおいては、ベリフィケーションが重要である。
例えば、医薬品が到着した際にデータロガーを確認し、逸脱がなかったことなどを確認するのである。
医薬品を輸送するコンテナーについては、あらかじめバリデーションしておくことが必要である。
例えば、90cmの高さからの落下試験や、温度変化に対する保温性などである。
「Cold Chain」のみではなく、偽造薬(counterfeit)、不良医薬品(falsified medicine)、不正流通、医薬品強奪等の問題が大きい。つまり偽造医薬品・不正流通リスクが増加しているのである。
米国では再包装業者の存在があり、欧州においては販売承認を取得していない輸入者が存在する。
したがって欧米においては偽造医薬品の混入のリスクがある。
現在、Black Marketのトップが偽造医薬品であり、年間$200Billionにも達するといわれる。
高級腕時計やバックに比べて、偽造品を製作する際にかかる原価は安価である。そのため、偽造医薬品の製造が後を絶たない。
また開発途上国では、輸送中のトラックごと盗まれてしまい、横流しが横行しているという。
PIC/SのGDPガイドラインの邦訳はこちらを参照されたい。
]]>Related Articles

- Understanding GDP: Good Distribution Practice for Pharmaceutical Products
- The Future of Japan’s GDP (Good Distribution Practice)
- PIC/S GUIDE TO GOOD DISTRIBUTION PRACTICE FOR MEDICINAL PRODUCTS(対訳)
- Good Distribution Practice For Medicinal Products For Human Use, Questions And Answers, Version 1.0(対訳)
- The Commencement of ER/ES Inspections by Regulatory Authorities: Historical Context and Current Practices
- FDA Form 483 Response Requirements and Best Practices


Comment