製薬業界においては、大掛かりな製造記録や品質試験記録の改ざん事件が後を絶たず、規制当局にとっても患者の安全性を確保するために査察を強化しなければならなくなっている。
紙媒体であれ、電子記録であれ、記録(データ)や文書の信頼性を担保することは極めて重要だ。
筆者は昨今世間をにぎわしている某製薬企業の不正について、ある大手新聞社のインタビュを3回にわたって受けた。
当該新聞記者の関心事は、日米の査察の方法の違いであった。
また米国において不正が発見された場合にはどのようなペナルティが課せられるかということであった。
ご存知の読者も多いと思うが、米国では極めて高額な制裁金が課せられる。
2002年には、QCデータを組織に敵に改ざんしていた某大手製薬企業に対して500M$もの罰金が科せられた。
インテグリティ(integrity)を辞書で引くと「誠実」という意味であることが分かる。
では、データが誠実ということは何を意味するのだろうか。
その答えは、規制当局にとってデータが信用できるということである。
そのためには、データは作成されてから現在までの経緯(例:変更)がわかるようにしておかなければならない。
つまり紙媒体であれ、電子記録であれ監査証跡が必要だ。
監査証跡が必要ということは、データが生データだけではなく、メタデータも含めて完全でなければならないということである。
したがって、データインテグリティは、しばしば意訳され「データの完全性」と訳される。
ではいったい、データの完全性を担保するためには、どのような事項に留意するべきだろうか。
またデータインテグリティが失われた場合、何が問題になるのだろうか。
その答えは、監査証跡の保持である。
監査証跡のない電子記録は、改ざんやねつ造の有無(証拠)がわからない。
したがって規制当局が査察を実施することができなくなってしまう。
なぜならば信用できるかどうかわからない記録を査察しても意味がないからである。
査察が実施できない場合、規制当局は医薬品の出荷を認めることができなくなってしまい、結果的に患者に迷惑がかかってしまうのである。
昨今の製薬企業では、記録を手書きにより作成することは非常に少なくなった。
多くの場合、記録は電子で作成されているだろう。
しかしながら、記録の保管については電子記録を紙媒体に印刷したものに手書き署名(記名・捺印)をするといったハイブリッドな使用方法が多くを占める。
しかしながら、ハイブリッドシステムでは不正が容易になってしまう。
つまり電子記録を改ざんした後に再印刷し、バックデートで署名するといった手口だ。
FDAの査察官は、電子記録の不正の手口を教育され、見破り方を身に着けているとされる。
電子記録と紙媒体の管理はどのように行うべきだろうか。
一方において、FDAは1997年に21 CFR Part11を発行し、電子記録の信頼性に関する要求事項を明らかにした。
しかしながら、その要件には実現が困難なものも多くあった。
特に問題となったのは、コンプライアンスコストだ。
規制当局は、患者の安全性を担保するために規制要件を強化する必要があるが、規制要件を強化しすぎるとコンプライアンスコストを高める結果となってしまう。
製薬企業が負ったコンプライアンスコストは薬価に転嫁され、結果的には患者負担となってしまう。
すなわち、いたずらにコンプライアンスコストを高めてしまうことは、逆に患者に負担を強いる結果となってしまう。
そこでFDAは、2003年に新しい医薬品監視指導方針として「リスクベースドアプローチ」という方法を発表した。
FDAの最新のPart11の期待と指導はどのようになっているのかを知っておく必要がある。
2015年には、イギリスのMHRAが「MHRA Data Integrity Definitions and Expectations」と呼ばれるガイダンスを発行した。
その内容は非常に参考になる。
今後は世界の規制当局が同じようにデータインテグリティに関する期待を述べる機会が増えると思われる。
データインテグリティとは
昨今、製薬企業や医療機器企業ではデータインテグリティに関する関心が高まっている。
データインテグリティを本邦では「データの完全性」と訳しているケースが多い。
しかしながら筆者はこの訳に違和感を感じている。
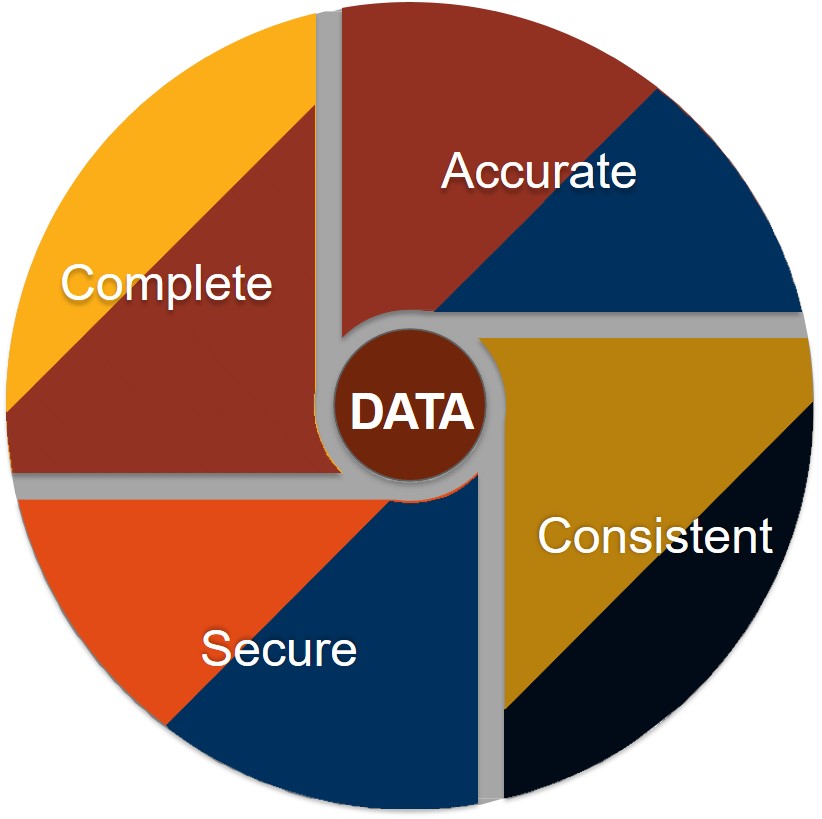
データインテグリティを構成する要素には以下の4つがある。
- Complete
- Accurate
- Consistent
- Secure
である。(図参照)
まずCompleteが完全性である。つまり完全性はデータインテグリティの一つであるがすべてではないのである。
次にAccurateは正確性である。データの正確性を証明するのはそう容易くはない。
例えば、使用した分析機器が適切に点検、校正されていたか。
試薬の有効期限が切れていなかったか、また試薬の種類や量を間違わなかったか。
分析結果の転記ミスはなかったか、また計算ミスはなかったか、などである。
果たしてこれらを第三者が客観的に確認できる記録が残されているだろうか。
Consistentは一貫性である。
一貫性とは更新された2つのデータレコードの間における、あらゆるデータの変更や改ざんがないことである。
データの再現性やトレーサビリティが重要となる。
Secureはセキュリティで保護されている状態である。
故意か事故かに関わらずデータが消失したり意図しない変更を加えられてはならない。
データインテグリティというとすぐにデータの不正を連想する人が多い、そうではないのである。
事故であれ、故意であれ、データが意図せず変更(改ざん)されてしまっては患者の安全性が担保できないのである。
つまり改ざんによってデータが変更された事象と、不注意でデータが変更されて事象では、患者に対する影響は同じなのである。
実は、手順書の不備(チェックの不備)や教育訓練の不徹底などによるデータインテグリティ違反は全体の80%にものぼる。
手順書の改訂やデータインテグリティに関する教育の徹底が望まれる。
また?データインテグリティのセミナーなどでは、Part11を引き合いに電子記録を中心に解説されていることが多い。
筆者はこれにも違和感を感じている。
データインテグリティは、紙媒体にも電子記録にも等しく適用される。
紙媒体のデータインテグリティ違反と電子記録のデータインテグリティ違反では、どちらも患者に対する健康被害は同じであるからである。
データインテグリティに関する規程・手順書
イーコンプレスでは「データインテグリティ規程・手順書」のひな形の販売を開始いたしました。
データインテグリティ規程・手順書 55,000円(税込)
【目次】
データインテグリティ規程
1. 目的
2. 適用範囲
3. 用語の定義
4. 背景
5. データインテグリティの原則
6. データガバナンス
6.1 データインテグリティのためのステップ
6.1.1 教育およびコミュニケーション
6.1.2 リスクの発見および低減
6.1.3 技術およびITシステム
6.1.4 データガバナンス
7. 手順書等
8. 参考
9. 付則
データインテグリティ手順書
1. 目的
2. 適用範囲
3. 用語の定義
4. 役割と責任
5. 啓発活動
6. 教育訓練
7. 関連する手順書の改訂
7.1 リスクマネジメント
7.1.1 リスクの検討
7.1.2 リスク低減策の検討
7.1.3 リスク低減策の実施
7.2 データライフサイクル
7.2.1 データの作成
7.2.2 データの処理
7.2.3 データのレビュ・報告・使用
7.2.4 データの保管・維持
8. コンピュータシステムの見直し、導入
9. 監視・測定
10. 監視・測定
11. 記録の保管
12. 参考
13. 付則
ご購入は こちら
【関連商品】
VOD 配信セミナー
当社VOD配信セミナーは、視聴期間および回数制限はございません。
お好きな時間に、繰り返し何度でもご視聴いただけます。
・改正GMPセミナーシリーズ データインテグリティ編
・ データインテグリティSOP作成セミナー
セミナービデオ
資料およびセミナービデオをダウンロードするためのURLを電子メールでご案内いたします。
DVDは別途郵送いたします。
・改正GMPセミナーシリーズ データインテグリティ編
・データインテグリティSOP作成セミナー
QMS(手順書等)ひな形販売
・データインテグリティ規程・手順書


Comment