改正GMP省令においては、医薬品品質システム(PQS)の導入に伴い、製造管理者の責務を見直した。
そのため製造管理者の責務が大幅に改定されているので注意が必要である。
改正後は品質部門に「品質保証に係る業務を担う組織」(品質保証部門:QA)を設置し、製造管理者がその組織を管理するイメージである。
2021年8月1日の改正GMP省令の施行までに、各社のSOPにおいても適正に改訂しなければならない。
製造管理者は薬機法第17条第6項に規定されている役割である。改正GMP省令においては、医薬品品質システム(PQS)の導入に伴い、製造管理者の責務を見直した。そのため製造管理者の責務が大幅に改定されているので注意が必要である。改正後は品質部門に「品質保証に係る業務を担う組織」(品質保証部門:QA)を設…
改正GMP省令の第5条は、医薬品の製造所(保管のみを行う製造所を含む)において製造管理者が行う業務について規定している。
第5条 第1項には下記の要求がある。(アンダーラインは従前のGMP省令からの変更点であり一から三号はほぼ全面改定である。)
製造管理者は、次に掲げる業務を行わなければならない。
一 品質方針及び品質目標を達成するため、製造所において、製造管理、品質保証及び試験検査に係る業務(以下「製造・品質関連業務」という。)が適正かつ円滑に行われるよう統括するとともに、医薬品品質システムが適切に運用されるよう管理すること。
二 医薬品品質システムの運用状況を確認するとともに、その改善を要するかどうかについて製造業者等に対して文書により報告すること。
三 原料、資材及び製品の規格並びに製造手順等が承認事項と相違することのないよう、品質保証に係る業務を担当する組織に管理させること。
四 品質不良その他製品品質に重大な影響が及ぶおそれがある場合においては、所要の措置が速やかにとられていること及びその進捗状況を確認し、必要に応じ、改善等所要の措置をとるよう指示すること。
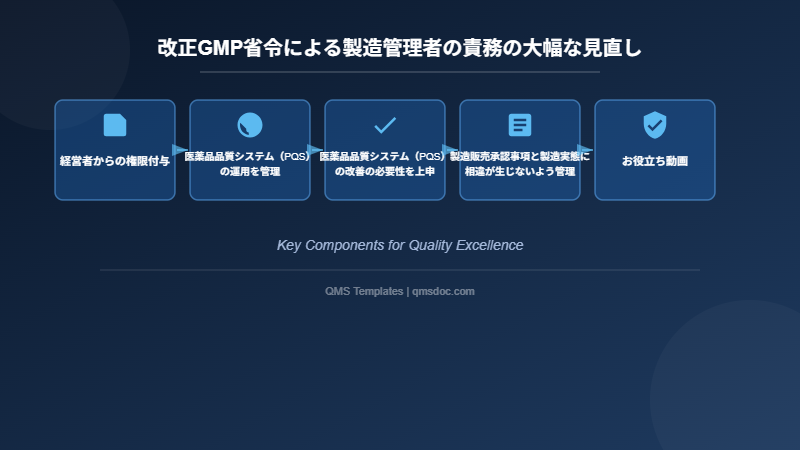
つまり、製造管理者は、
(1)医薬品品質システム(PQS)の運用を管理
(2)医薬品品質システム(PQS)の改善の必要性を上申
(3)製造販売承認事項と製造実態に相違が生じないよう管理
などの責務を負う。
経営者からの権限付与
製造管理者は、製造・品質関連業務が適正かつ円滑に行われるよう統括するとともに、医薬品品質システムが適切に運用されるよう管理する立場にあり、当該製造所における製造・品質関連業務について権限と責任を有する者でなければならない。
つまり経営者(代表者を含む薬事に関する業務に責任を有する役員)は製造管理者に対して独立した権限と責任を与えなければならない訳である。
ここで独立した権限とは、経営者は製造管理者の業務を妨げてはならないということである。
医薬品品質システム(PQS)の運用を管理
製造管理者は、医薬品品質システムの運用状況を確認し、PQSや資源に改善が必要であれば、経営者へ文書で報告しなければならない。
一方、経営者は製造管理者からの報告書(製造管理者が自らの責任で作成したもの)を踏まえ、必要な資源(リソース)の配分をしなければならない。
資源とは、いわゆる人・モノ・金である。
医薬品品質システム(PQS)を適正に運用し、品質改善を図るためには、
・力量のある要員の雇用
・要員の教育訓練
・必要な設備・装置・システム等の購買(老朽化した設備等のリプレースを含む)
などが必要である。
つまり経営者は、資源を供給することによって製造管理者の業務遂行に必要な支援を行わなければならない。
単なる精神論や根性論では品質は改善しないのである。
医薬品品質システム(PQS)の改善の必要性を上申
医薬品製造管理者は、薬機法の規定により、医薬品の製造の管理を公正かつ適正に行うために必要があるときは、経営者に対し、意見を書面により述べなければならない。
つまり、上層部との情報伝達(コミュニケーション)が重要である。
なお経営者は、医薬品製造管理者の意見を尊重し、法令遵守のために必要があるときは適切な措置を講じなければならない。
製造販売承認事項と製造実態に相違が生じないよう管理
製造管理者は、原料、資材及び製品(中間製品を含む)の規格並びに製造手順等が承認事項と相違することのないよう、品質保証部門に管理させなければならない。
また製造管理者は、品質不良など製品品質に重大な影響が及ぶおそれがある場合において、当該部門や品質保証部門によって所要の措置が速やかにとられていること及びその進捗状況を確認しなければならない。
さらに必要に応じて、改善(是正措置・予防措置等)を、各責任者および要員に対して指示しなければならない。
ICH Q10の医薬品品質システム(PQS)の概念は難しい。
製薬企業のSOP作成者はもとより改正GMP省令が発出されたことにより、多くのセミナーや書籍の出版などが予想されるが、どれだけの人が正確に“品質システム”について理解しているのか、疑問に思うところである。 “品質システム”の概念は、ISO 9001 品質マネジメント規格を良く理解していなければ、適切な運用は困難であろう。
お役立ち動画
関連商品
[blogcard url=”https://ecompliance.co.jp/SHOP/O064.html” title=”【VOD】日本一わかりやすい【超入門】改正GMP省令セミナー” content=”厚生労働省は「医薬品および医薬部外品の製造管理及び品質管理の基準に関する省令」(GMP省令)の一部を改正する省令(厚生労働省令第90号)を発出しました。2021年8月1日の施行を予定しています。
GMPの改正に伴い、この際基礎からGMPを学びたいという方々のために『超入門改正GMP省令セミナー』を企画いたしました。
改正GMP省令では、医薬品品質システム(ICH Q10)、品質リスクマネジメント(ICH Q9)、データインテグリティ、マネジメントレビュ、品質マニュアルなどの難解な用語や概念が出てきます。
これらを日本一わかりやすく解説いたします。
1回聞いただけでは理解できない方にも、アーカイブ配信を繰り返し視聴して頂けたら、きっとGMPを熟知できるようになるでしょう。
本セミナーは、これからGMPを勉強する方にもわかりやすく、基本からお話しを致します。また既にGMPを理解されている方にも再確認して頂ける内容となっています。
本セミナーでは、品質マニュアルのサンプルも配布いたします。”]
2021年8月1日の施行を予定しています。
GMPの改正に伴い、この際基礎からGMPを学びたいという方々のために『超入門改正GMP省令セミナー』を企画いたしました。
改正GMP省令では、医薬品品質システム(ICH Q10)、品質リスクマネジメント(ICH Q9)、データインテグリティ、マネジメントレビュ、品質マニュアルなどの難解な用語や概念が出てきます。
これらを日本一わかりやすく解説いたします。
1回聞いただけでは理解できない方にも、アーカイブ配信を繰り返し視聴して頂けたら、きっとGMPを熟知できるようになるでしょう。
本セミナーは、これからGMPを勉強する方にもわかりやすく、基本からお話しを致します。また既にGMPを理解されている方にも再確認して頂ける内容となっています。
本セミナーでは、品質マニュアルのサンプルも配布いたします。”]
]]>


Incredible points. Solid arguments. Keep up the amazing effort.