リスクとは、起きるか起きないかわからない問題、これを「リスク」という。
リスクは未来形である。安全性に関しては、医療機器が市場に出て実際に使用された時にどんな危害が発生するかを、設計段階で知恵を絞って推定し安全設計をする必要がある。
なぜならば、リスクは試すことができないからである。リスクを顕在化させ患者・使用者にどのような健康被害が生じるか、など実際に試すことができない。
特に医療機器にはこのリスクがあるので、その安全設計というところが最も強調されている。
機器設計の有効性の評価については、臨床試験や臨床評価に委ねることが多い
医療機器と安全性を理解するためには、まずリスクを正しく理解する必要があるリスクとは、起きるか起きないかわからない問題、これを「リスク」という。リスクは未来形である。安全性に関しては、医療機器が市場に出て実際に使用された時にどんな危害が発生するかを、設計段階で知恵を絞って推定し安全設計をする必要がある…
医療機器リスクマネジメントとは

医療機器にはリスクマネジメントは必須である。
何故ならば、医療機器には何らかのリスク(危害の潜在的な源)が存在しているからである。
そもそも世の中の製品で”安全”というもの何一つない。あるのはリスクのみである。
リスクフリーということはない。日本に住む人たちにとっては、安全神話やリスクフリー信仰やリスクゼロ信仰というものがある。リスクはゼロでないと許さないっていう風潮があるが、そんなものは世の中に何一つない。すなわちリスクしかないのである。
大事なことはそのリスクを極めて低減し、受容可能なまで低減するということが必要であるということである。
何らかのリスクを抱えた状態で市場へ出荷され、事故が起る前に予防策として、あらゆるリスクを検出し、それによって消費者(患者・ユーザー)に危害を及ぼさないようにするのがこの活動の主目的である。
市場からの製品(類似製品を含む)に対するフィードバック情報も重要な要素となる。
この活動はPDCAを基本としている。
ISO-13485(JIS Q 13485)規格からも、「医療機器の製造管理および品質管理に関する省令(医療機器QMS省令)」からも、このリスクマネジメントの適用・活動が必須となっている。
ヘルスケア産業におけるリスクというのはあくまでも「患者ユーザーに対する健康被害」のことですのでお気を付け頂きたい。
よく勘違いされるのは、例えば製造工程で製造する人が怪我をするリスクとやサービスマンが怪我をするリスクを考える方がおられるが、それは規制されていない。
考える必要はあるが、規制要件が規制しているのは、あくまでも医療機器の患者・ユーザーに対する健康被害(リスク)定義しているので間違えないよう注意いただきたい。
医療機器におけるリスクマネジメント
「ISO-14971「医療機器―リスクマネジメントの医療機器への適用」2019年12月
・医療機器の欠陥(故障、誤使用等)が患者や使用者に及ぼす「健康被害」を管理
・設計管理においてリスクマネジメントを実施(リスク分析結果は設計管理のインプット)
・財産若しくは環境の受ける影響も対象」
医療機器におけるリスクマネジメントは、ISO14971というものがある
「医療機器リスクマネジメントの医療機器の適用」というタイトルがついている。
2019年12月版に改訂されたものが最新版である
これは特に設計管理においてのリスクマネジメントを要求しているということである。
このリスク分析の結果は設計管理のインプットとなる。
従って、設計を始める前までにリスク分析を終えなければならないということである
リスク分析は先程の絵でご紹介したように、その当該医療機器にはどんなハザードがあるのか、そのハザードへの暴露がどれくらいの確率で起きるか、それによってどんな健康被害が起きるか、その重大性と発生確率を掛け合わせたものを設計のインプットとして安全機能設計しなければならないということである。
なぜならば患者・ユーザーは有効性を要求されるが、安全要求に関しては、設計が自身で安全な設計のインプットを作らなければならないということになっているからである。
機器設計 機器要求事項とリスク分析の関係
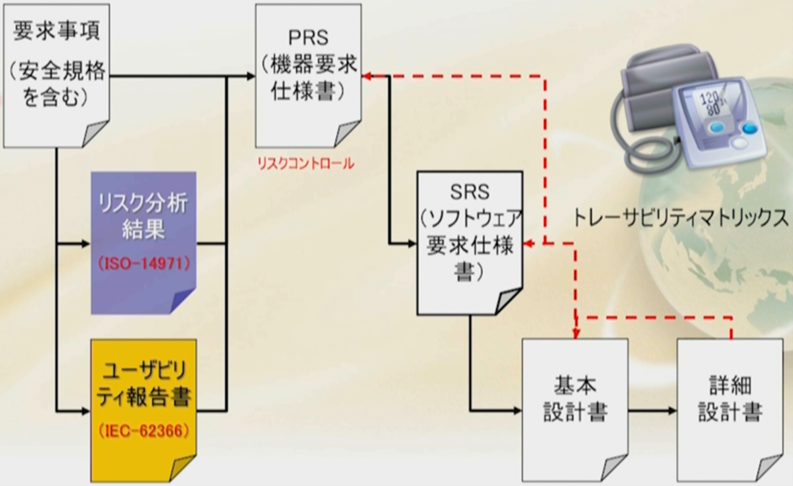
まず図の左上の「顧客の要求事項」で要求事項を文書化する必要がある。例えば医療機関の医師の方々、検査技師の方々、または患者の方々から来た機能の要求、性能の要求、言ってみれば有効性の要求、ところが、患者・ユーザーの方々からは、なかなか安全性に対する要求は出てこないので、設計段階で考えをめぐらし推定し安全設計をする必要がある。
そのために安全規格というものがある。例えば、IEC60601-1医療用を目的とした電気機器の安全性を定める規格であったり、生体適合性であったり、その他安全規格がある。これら安全規格の遵守は必須要件となっている。
プラスして、「リスク分析結果」、今回設計しようとしている品目の特性特質分析をしていただき、想定されていないハザードを抽出し、そのリスクを分析していただく、これをISO-14971に則って実施する必要がある。さらに「ユーザビリティ報告書」は「ユーザビリティエンジニアリング」をIEC-62366に従って行う必要がある。
これら、「リスク分析結果」と「ユーザビリティ報告書」の二つの安全要求を足し合わせて「機器要求仕様書」PRS (Product Requirements Specification)を作らなければならない。
ここまでが設計のインプットである。
このPRSをさらに、仕様書に展開していく
先ほどME機器(医用電気機器)で述べたように、ME機器というのはメカ、エレキ、ソフトでできていますので、ソフトウェアの要求仕様書、ソフトウェアの基本設計書、ソフトウェアの詳細設計書、それから、メカの要求仕様、メカの基本設計、メカの詳細設計書、それから、エレキの要求仕様書、エレキの基本設計書、エレキの詳細設計書という風に仕様書が分かれていく、それらの仕様書の整合性をとって安全な医療機器を作らなければならない。
リスクの定義 (ISO /IEC Guide51)
リスクとは、危害の発生の確率とそれが発生した時の重大性の組み合わせである
combination of the probability of occurrence of harm and the severity of that harm (ISO /IEC Guide51)
実はこのリスクの定義は極めて我々の普段の思考のパターンと似通っている。
筆者は出張が多くよく飛行機に乗る。
飛行機が万が一墜落した場合、破局的で、まず助からないことはお分かりと思う。
重大性はかなり高いことは分かっていても、なぜ飛行機に乗るかというと、ほぼ墜落しないと考えているからである。確率がゼロに近いという風に考えているからである。
頭の中で確率と重大性を掛け合わせて、それぐらいのリスクだったら取ろうという風に考えて飛行機に乗るわけである。
このように人間は普段の生活の中で、常に重大性と確率を掛け合わせてリスクを判定している。
ここでひとつ大切なことを申し上げたい。
危害の発生の確率であって欠陥の発生する確率はないということにご注意頂きたいと思う。
欠陥がどれくらいの確率で発生するかを求めるのではなく、危害がどれくらいの確率で発生するかということに注意いただきたい。
リスクとは?

リスクの定義、発生確率と重大性を掛け合わせたもの、これをR -MA Pと言う。
重大性を横軸、発生確率を縦軸に掛け合わせる。HighかけるHighはVery Highなので真赤かである。LowかけるLowはVery Lowなので緑色になっている。
このように、もし赤色とかオレンジ色とか黄色に分類されるリスクがあった場合、重大性を下げるか、発生確率を下げて、緑の領域に入れて、安全な医療機器を作らなければならないということは直感的にお分かりになると思う。
リスク評価の実際 (R-Map法)
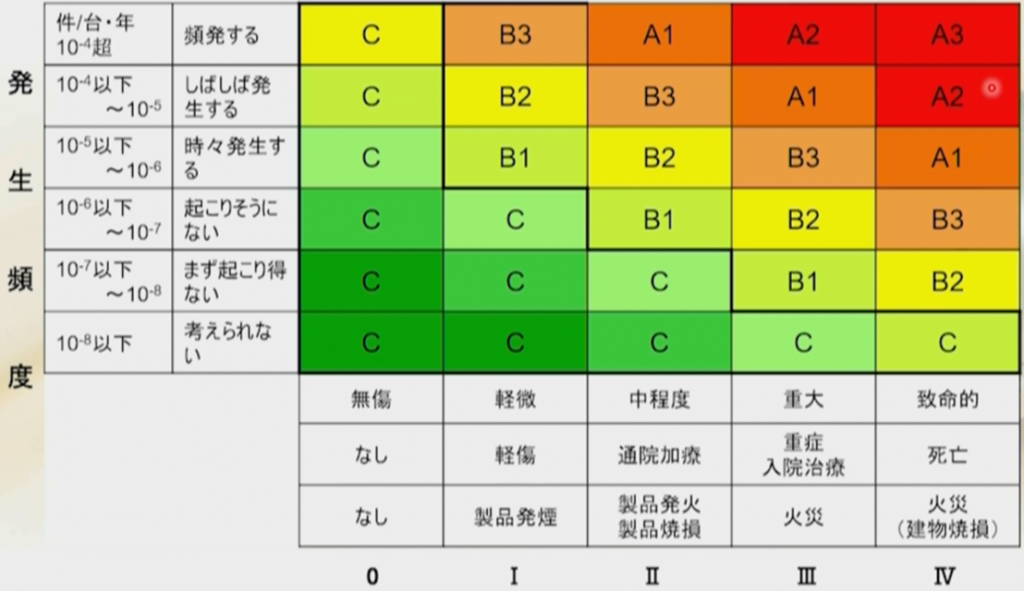
このR-MAPにABCというランク付けを行う。
AとBは受容不可、これは医療機器としては市場に出すのはちょっと憚られる。
Cのところは問題がないので、これくらいのリスクだったら受容可能なので医療機器として発売できる。患者・ユーザからは、そういうリスクなら受け入れましょうということになる。
横軸の重大性の一つ目は、致命的、重大、中程度、軽微、無傷と言ったような定性的すなわち比較である。こっちよりこっちの方が大きいこっちよりこっちの方が小さいという比較、これを定性的と言う。
もう一つは、死亡、重症入/院治療、通院/加療、軽症、なし。これが定量的である
当然リスクマネジメントというのは定量的にやるほうが望ましいが、リスクは試せないという問題がある。
有効性は試すことができる。例えば臨床評価とか臨床試験によって、その医療機器の有効性は試せるが、例えばこんな結果を潜ませてみたら患者にどういう健康被害が生じるか試してみようということはできないのである。
ゆえにこの定量的な評価というのはなかなか難しい。
縦軸の発生頻度の一つ目は、頻発する、しばしば発生する、時々発生する、起こりそうにない、まず起こり得ない、考えられない、これが定性的、すなわち比較である。
もう一つは、10のマイナス4乗を超える、10のマイナス4乗以下、10のマイナス5乗以下、10のマイナス6乗以下、というのが定量的である。
ちなみ10のマイナス6乗というのは1ppmのことで、1ppmは百万分率とも言う。
100万回に1回発生する確率ということになっている。
どうやって安全にするのか
医療器具をどうやって安全にするかということだが、そもそも医療機器に限らず、ものは必ず壊れるし、ものは必ず故障する。
そのためにフェールセーフの設計(Fail Safe Design)をしなければならない。
それからフォールトトレランスのデザイン(Fault Tolerance Design)をしなければならないということである。
フェールセーフとは、もし転んだとしても安全なほうに転ぶように設計をしなければならないということである。
もう一つは、ヒューマンエラーがある。
人は必ず間違える、人は必ず忘れる。これは設計者にはどうしようもないところがある。
設計だけでは、ヒューマンエラーは完全には防ぎきれない。
ヒューマンエラーをどうやってマネジメントするか、いかにヒューマンエラーを少なくするかというのは喫緊の課題である。
昨今ヒューマンエラーが多発しており、それによって医療機器のヒューマンエラー基づく医療過誤が多発している
そもそも医療機器における事故というのは、設計者とユーザーのギャップで発生する
医療機器で大切なことはユーザーの要求と製品の仕様、その医療機器の仕様が合致していることである。
実際のユーザーの思惑と設計者の思惑にギャップがあった場合、安全にならない。
設計者とユーザーのギャップで医療機器の事故が起きるとされているので、ユーザー要求を正しく理解して正しい適切な設計を行うことが極めて重要である
前述で飛行機に搭乗することについて述べた。
飛行機というのは墜落したらほぼ全滅する非常に危ないものだという事をご承知だと思う、ではなぜ航空機に飛行が許されているかということを述べたい。
アメリカの国家運輸安全委員会の行った調査によると、航空機に乗って死亡事故に遭遇する確率は0.0009パーセントである。
アメリカ国内に限ればもっと低くて0.000034パーセントとなる。
これを確率論に置き換えると8200年間、毎日無作為に選んだ航空機に乗って、一度事故にあうかあわないかという確率なのである。
自動車事故による死亡事故の発生確率が0.03パーセントなので、航空機による事故にあう確率は、自動車事故によって死亡する確率の33分の1以下だということである。
今、あらゆる輸送手段において航空機が最も安全であると言われる由縁である。
このことを実際に証明したデータがある
2001年9月のアメリカ同時多発テロの事件の後、アメリカ人の多くが民間航空機による移動を避けて自家用車による移動を選択したために、同年の10月から12月までわずか3か月の間に、アメリカにおける自動車事故による死者の数は前年比で約1000人増加した。
このことから何をしなければならないかと言うと、危害の発生確率を極めて低減させることが重要だということである。
ご記憶いただきたいことは、重大性はほぼ下がらないということである。
筆者の経験から、多くの医療機器メーカーで間違われるのは、重大性を何とか下げようとされるのだが、重大性はほぼ下がらない。
例えば熱いものに触っても火傷しないことにはならない。
例えば放射線を浴びても、被爆しないということは起きない。
よって極めて接触しないようにする、被爆しないようにする、という発生確率を下げることに注力していただきたい。
一般的なリスクマネジメントプロセス
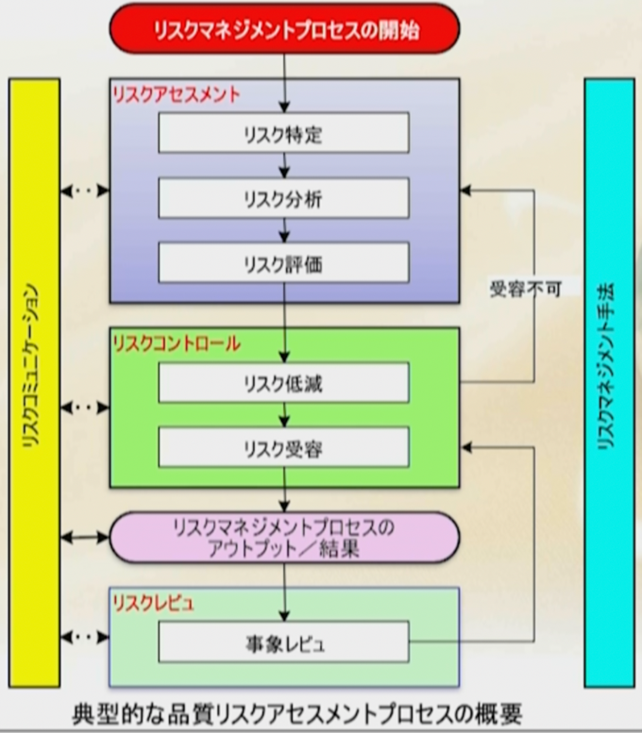
リスクマネジメントをどうやるか?
これは一般的なフローチャートだが、リスクマネジメントと聞くすと非常に複雑なように思われるかも分からない。
ところが実はスリーステップメソッドと言って三つの箱しかない。
①「リスクアセスメントの箱」
リスクアセスメントは日本語でリスク調査のことなので、どんなリスクあるかをまず調査する。
②「リスクコントロールの箱」
リスクが分かれば、そのリスクをコントロールする。つまり安全策、安全装置の設計である。
③「リスクレビューの箱」
リスクが実際にコントロールされているかどうかを市場でモニタリングしなければならない。なぜならば、リスクは試すことができないからである。
市場に出ている製品の使用状況をモニタリングすることによって、本当にリスクが制御されたかどうかを把握する。
【例】PCプロジェクターにおけるリスク
1つの例を紹介する。
例えばPCのプロジェクターを使ったときを考える。
Step 1、そのPCのプロジェクターでまずハザードを見つける。
例えばPCのプロジェクターを見ると、光が出ている、熱がある、それから温風、ファンが温風を出している、目には見えないが電磁波も出ている、電力も使用している。
机の上に置いたり天井からぶら下げたりしていると重力というものもある。
こういうものをハザードという。
ハザードというのは危険の源になる。
医療機器を設計する前に、一体どういうハザード(危険の源)があるかを抽出する必要がある。
Step 2、危険状態を推定する。
例えば熱を例に取ると、熱が高温状態になると危険状態となる。
これはまだ危険な状態であって実際に健康被害が起きたわけではない。
Step3、危害を推定する。
その高温状態になった部位に人が接触した場合、やけどという危害が発生する。
その被害が発生することが順当に推定されるので、ここにはリスクがあるということがわかる。
Step4、リスクを推定する
リスクは重大性と発生確率をかけたものである。
では、この場合の重大性はいくらぐらいか?
やけどなので5段階で評価すると5ということはない。例えば、3くらいとする。
次に発生確率は、プロジェクターに接触して火傷する確率はどれくらいあるのか、これが非常に難しい。高温状態になる確率はほぼ100パーセントだと考えられるが、問題はどれくらいの確率で接触するか、これがわからない。すなわち発生確率って実はものすごく曖昧なのである。
よって、あまりこの初期の段階でどれくらい発生確率があるかは、気にしなくて構わない。
設計が終わってから発生確率がどこまで下がったかということを評価することが重要であって、初期の段階では100パーセントと入れておいて構わない。5段階だったら5として良い。この場合は、3×5で15というリスクレートが出る。
このように最初からどのような危害が発生するか、どんなリスクあるかということを推論するのではなく、まずハザードを探して頂きたい。
ハザード (hazard) の例 (ISO-14971)

後で紹介するISO14971という医療機器に特化したリスクマネジメントの国際規格の中に書かれているが、ハザードの例には、エネルギーのハザード、生物学的及び化学的ハザード、操作上のハザード、情報のハザード、というものがある。
例えば、エネルギーハザードでは、電磁エネルギーとか熱エネルギー、さっき例でお示ししたように高温状態、力学的なエネルギー、これも重力というのがある。音響エネルギーもある。
生物学的及び化学的ハザードでは、バクテリアウイルス、化学薬品と酸アルカリ、残渣、残渣は、例えば洗浄しても残っているキャリーオーバーのことを残渣と言う。それから生体適合性。
操作上のハザードでは、不注意や記憶間違い、規則に基づいた不良、日常的な違反いわゆるヒューマンエラー、これもハザードになる。
情報ハザードでは、ラベリング、ラベリングというのはあらゆる患者・ユーザーが目にする印刷物をラベリングと言う。その中でも特に重要なものが取扱説明書である。取扱説明書が曖昧であったり、間違っていたりした場合、患者・ユーザーに多大な健康被害の恐れが生じる。よって、このラベリングというもの、あらゆる印刷物に対しても設計者は適切に設計し、設計レビュー、デザインレビューをした上で発行しなければならないということになっている。あるいは警告、例えば医療機関の中でアラームがあちこち鳴っているとする。どの機器が何を言っているのか全くわからないということが起きても問題になる。そういう警告も一つのハザードに数えられる
ハザード、危害、リスク
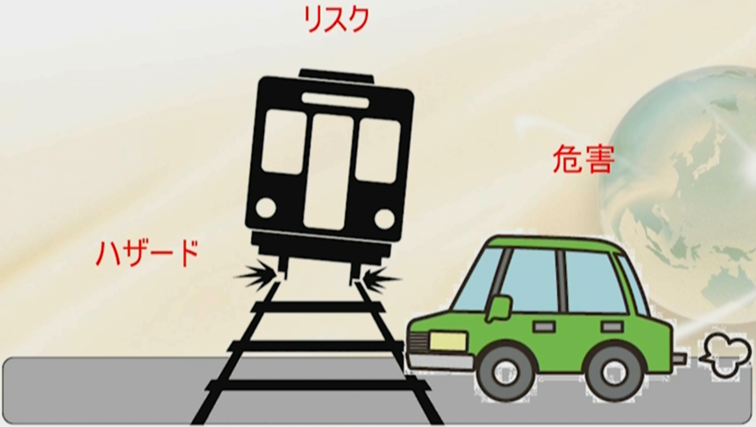
先程、スリーステップメソッドご紹介した。
わかりやすく例えで述べる。
車道と鉄道が交差しているとする
まずは、最初からリスクを探すのではなく、ハザードを探して頂きたい。
この絵を見ると、まず電車があり、自動車がある。ただし電車も自動車も止まっていると何も問題は起きない。この場合、正確にハザードは何かと言うと、電車のスピード、自動車のスピードである。
まずハザードが分かった。
そのハザードが暴露した場合は、どのような危害が考えられるのか?
これは自動車のドライバーまたは同乗者が死傷する、電車の運転手乗客が怪我をするという危害が推定できる。
ここにリスクがあることがわかった。
では、リスクマネジメントを実施する。
3つのステップである。
Step1リスクアセスメント(リスク評価)
リスクの定義は危害の発生確率とそれが発生した時の重大性の組み合わせである
まず重大性はどれくらいあるのか?
死傷事故なので、これは最も重大で、5段階であれば5、100段階であれば100である。ここでは5とする。
一方で発生確率はいくらあるのか?
これがわからない、なぜ分からないかと言うと、もしこの現場が都会だったら頻繁に起きるが、田舎だったらさほど起きないかもしれない。
したがって、発生確率は初期の段階ではものすごく曖昧なのである。
では、田舎を想像した方、都会を予想した方、
田舎の場合は3と入れ、都会だったら5と入れるとする。
次にStep 2、リスクコントロールである。
リスクのコントロールすなわち安全策の設計である。
都会を想像された方は発生確率ゼロにしなければならないがどうしますか?
例えば車道橋を渡しましょう、または鉄道を高架にしましょう
これによって何が起きましたか?
発生確率がゼロになったわけなのである。
しかし、一方で田舎を想像された方は、もし田舎において車道橋を渡したり高架を作ったりしてしまうとコストに見合わない。では何をするのか?
この場合は、例えば踏切を作る、信号灯を設置する、警報音を設置して鳴らす、遮断機を設置する、これらの安全策により、これでほぼリスクがコントロールできたことになる。
発生確率はゼロに近づいたと考えて良い。
大事なことは、本当にこのリスクコントロール策が有効であるかどうかを評価することである。そのためにリスクデビューを行う。安全策が機能しているかどうかをモニタリングする。
だが田舎だと思っていた地域もいつしか商業施設が増えてベッドタウン化し、自動車の往来が増え、電車の本数も増えてくる。起きないと思っていた死傷事故も年に二回三回と起きてしまう。そうするとまたリスクアセスメントをやり直すということになり、リスクマネジメントというのはPDCA (Plan, Do, Check, Action)が常に製品のライフサイクル中で回り続けるということなのである。
なぜアクセルとブレーキを踏み間違うか?
よく交通事故が起きた時に、アクセルとブレーキを踏み間違えたということが新聞などで報道されている。
なぜアクセルとブレーキを踏み間違えるのかと不思議に思う。
ところが人間というのは、実は焦ってしまうと、間違ってしまうのである。
人というのは間違う生き物なのだ。
例えば、運転中に運転中に携帯電話の着信音などがあると注意力が低下してしまう。
この時、人は何か不意をつかれた時に普段使い慣れた機能を使うという行動性行があるため、アクセルとブレーキを踏み間違えてしまうことがある。
人が自動車を運転している時、アクセルを踏んでいる時間と、ブレーキを踏んでる時間どっちが長いであろうか?当然アクセルである。
人間が何かびっくりした時には、どうしてもアクセルを踏んでしまうので、これがアクセルとブレーキを踏み違う一つの要因になる
間違える要因はこれだけではないが、アクセルとブレーキの位置関係だとか、そういう問題もあるが、それが一つの要因になっているということである。
こういったヒューマンエラーをいかに防ぐかということが重要になってくるということである。
医療機器のユーザビリティエンジニアリングにとって大切なこと
・ユーザビリティには「使いやすさ」、「ユーザの満足度」および「見栄え」も含めているが、医療機器設計開発で求められているのは使用エラーのない「安全」な医療機器である。
・従って、医療機器に適用しているユーザビリティエンジニアリングは使いやすさを評価するものではなく、使用エラーのない安全な医療機器を設計するための分析手法である。
そこで医療機器においては、ユーザビリティエンジニアリングというものが大切になってくる。医療機器は当然使いやすくしてユーザーの満足度、及び見栄えというものも向上させなければならないが、何よりも使用エラーのない安全な医療機器を設計しなければならないということである。
使い捨てのライターのユーザビリティエンジニアリングの例
使い捨てライターのノックが非常に重いことは周知のことである。なかなか火がつきにくい。
何故かというと、例えば子供がイタズラをして小火(ぼや)を出さないために火事を起こさないためにわざと使いにくくしているのである。
わざと使いにくくすることもユーザビリティの一つである。
医療機器はこのようにフェールセーフ設計をすることも極めて重要だ。
決して使いやすくすることだけが医療機器のユーザビリティエンジニアリングの目的ではないということをご記憶いただきたい。
どのような環境でどのような人が操作するかも重要
医療機器にはいろいろな種類がある事はご紹介したが、例えばどのような環境でどのような人が操作するかっていうことも重要なのである。
野次馬に囲まれて取扱説明書を読む暇もなく、初めて使用するAED除細動器、こういうものもある。
1分1秒を争うAED除細動器というのは、もうその効率安全性にとても影響を与える。
取扱説明書を読まなくてもよくて、それから極めて安全な設計になっている。
また、初めて使う人にも容易に使えるような設計にしなければならないということである。
それから医療機器と聞けば、多くの方々は医療機関の中または、ご家庭で使われる医療機器を想像するかも知れないが、例えば救急車の中で振動と共に使用しなければならない心電図計とか血圧計、体温計などもある。そういう急激な加速度とか震度の中でも正確に測定できるような医療機器というものも要求されるわけである。
意図した使用に仕様を合わせるのは最重要
医療機器というのは、意図した使用に対して安全性が異なる。
例えば一本の棒切れがあったとする。
これをアイスキャンディの柄に使うと、そんなにリスクは高くない。
ところが医療機関で、特に内科で使う圧舌子(舌を押さえる器具)として使った場合は、リスクが異なる。
つまり同じ部材同じ部品を使っても使用する用途によってはその安全性が異なるということである。
人間の場合臓器によっても安全性が異なる。
例えば脳と心臓と肺というのはもし損傷を起こすと、すぐに生命が断たれる。
一方、腎臓とか膀胱がたとえ傷ついても即生命に影響することはない。
下部消化管などは、そんなリスクが高くない。
または疾患によっても異なる。
悪性腫瘍なんかになってくると例えば診断装置で悪性腫瘍を良性と判断してしまうと、偽陽性とか偽陰性というのは聞かれたことがあると思うが、例えばフォールスネガティブ、悪性なのだけれど良性と判断してしまうと、これは医師にとって処方ミス、処方遅れ、治療遅れ、誤処方、誤治療につながる。
それよって患者の容態が悪化して死に至るということもあるのである。
よって、使用目的をよく理解した上で機器の設計をすることは極めて重要であるということを繰り返し申し上げたい。
医療機器におけるユーザビリティーエンジニアリング
「IEC-62366-1:2015
3.16 ユーザビリティ
使いやすくして、またそれによって意図する使用環境において有効性、効率およびユーザーの満足度を確立するユーザーインターフェースの特性
備考1: 有効性、効率およびユーザーの満足度を含むユーザビリティの全ての側面は、安全性を増加または減少させることがある。」
IEC-62366-1は、ユーザビリティエンジニアリングに関する国際規格で2015版が最新である。
ここにユーザビリティというのは、使いやすくしてまたそれによって意図する使用環境において、有効性、効率およびユーザーの満足度を確立するユーザーインターフェースの特性とある。
このユーザビリティエンジニアリングというのは、大雑把にいうとユーザーインターフェースにおけるヒューマンエラーに特化したリスクマネジメントというようにも理解できる。
なぜならば、例えば、機器がディスプレイに表示しているものを見て、人が次のアクションをコマンド入力する。その時に表示を間違って捉えて、間違ったコマンドを叩くと機器は間違った動作をする。間違った動作をするので、また人は間違った次のアクションを入力する、これが悪循環になって事故に至るのである。
そういったインターフェイスに注目し、ヒューマンエラーをいかに少なくするかというのがユーザービリティだ、大雑把にいうとそう言い方ができる。
インターフェイスは何もディスプレイだけではない。
例えばボタンの形、例えば色弱の方が介護用のベッドで昇降する時に「丸いボタンは上がる」「三角のボタンは停止する」「四角のボタンは下がる」のように形でわかるようになっているものや、またはアラーム(聴覚)ですね、音によって何かを表すもの、それから色ですね赤い線がプラス青い線がマイナスのように色で判断するものがある。
このように、人の五感、視覚とか聴覚とかそういうものによるものの全てがインターフェースになるということである。
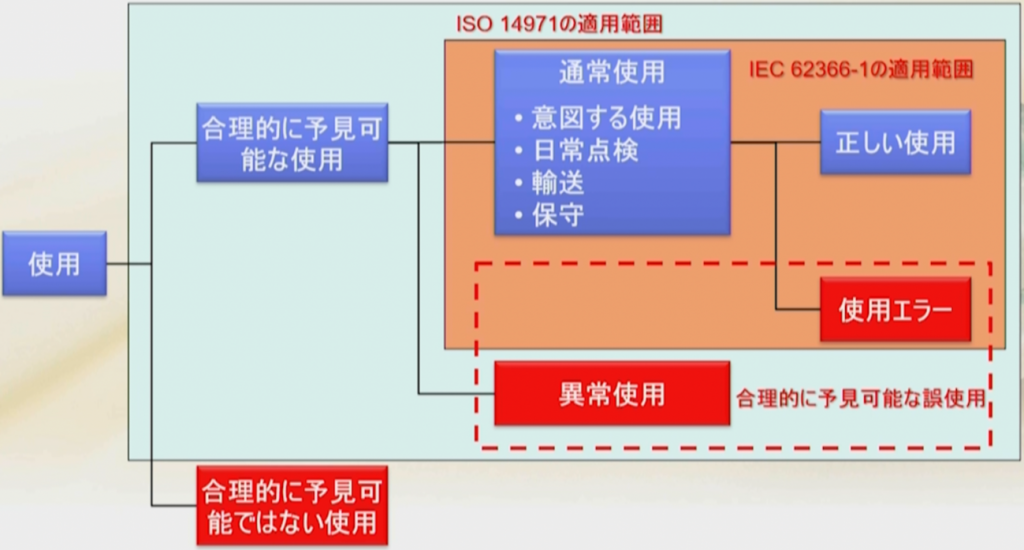
ISO 14971 (リスクマネジメント)とIEC 62366(ユーザビリティエンジニアリング)の適用範囲の違い
ISO 14971とIEC 62366の区別がつかないという方が非常に多くいらっしゃるので図で紹介する。
左から、医療機器の「使用」は、「合理的に予見可能な使用」と「合理的に予見可能ではない使用」の2つに分かれる。
当然設計において注視しなければならないのは、「合理的に予見可能な使用」であり、多分ユーザーの方々は、こういう使い方をするだろうという事を推定しなければならない。
逆にいうと、予見不可能なものに関しては、リスクマネジメントの適用範囲はなっていない。
では「合理的に予見可能な使用」には何があるかと言いますと、通常使用というものがある。
通常の通り、取扱説明書の通り使うことを通常使用という。
ここでご留意いただきたいことがある。
ユーザーの皆さんは取扱説明書に従って通常の通り使用するのだが、正しい使用をできる人と使用エラーを起こす人に分かれる。
なぜならば、例えば女性の方、老人の方、何かの病気疾患を患っている方、子供、そういった方が、力がないことによって正しく使いたいのだけれど使えない、文字が読めない、音が聞こえない、そういう何だかの身体的な特徴とか体力的な問題とか原疾患(今お持ちの病気)によって正しく使いたいけれども使えない、こういう使用エラーが生じるということが極めて重要なのだ。
そこをマネージメントしなければならないのがIEC 62366であり、これがユーザービリティエンジニアリングの適用範囲になっている。
もう一つISO 14971は異常使用というものがある。合理的に予見可能な異常使用というものがあり、合理的に予見可能な誤使用というものがある。ここまで含めて14971の適用範囲になっている。
要するに14971の場合は、正常使用だけではなくて、異常使用も含めてマネージメントしなければならないということである。合理的にこんな使い方をするユーザーがいるだろうということを推定して、いかにそのリスクを防ぐかということを検討しなければならないということになっている。
なぜユーザビリティエンジニアリングが必要か?
では、なぜユーザービリティエンジニアリングが必要かということを、実際に起きた事故でご紹介したいと思う。
輸液ポンプで起きた事故の例である。
ユーザーが輸液ポンプ(Infusion pump )の流量と予定量の入力を間違った。
流量と予定量の設定を同じスイッチで切り替えて入力するタイプの輸液ポンプで、流量設定が30mL/hのところ、900mL/hと入力してしまって患者が呼吸停止する等の事故が多発した。
これは当然医療過誤である。そのユーザーの方の不注意ヒューマンエラーである。
しかし、そもそもなぜそんな医療機器を設計したのかということであり、これは合理的に予見可能な誤使用である。
当然設計者はそういう誤使用、ヒューマンエラーが起きるって事を想像して推定して設計をしないといけなかったということなのだ。
このように、ユーザビリティエンジニアリングは極めて重要であり、多種多様なユーザーがいらっしゃるわけで、医師、看護師、介護士、患者、それぞれユーザの習熟度もまちまちである。
例えば取扱説明書も読まずに家庭で母親がアナフィラキシーショックを起こした時に、子供が緊急で母親に打たなければならないペンタイプの注射針もある。
どういう方が使うかによっても、安全度が異なるのだ。
特に昨今は医療機器が複雑化してきており、直感的な操作が難しくて操作をなかなか覚えられない、ということがある。
この正しく取扱説明書の通り使うのだけれども、使用エラーを起こしてしまうという事故が起きており、これをいかに防ぐかが喫緊の課題なっているということなのである。
ユーザビリティエンジニアリングによって「安全」な医療機器を開発する。ということが必要である。
直感的な操作は可能である。例えばバリデーションをするときに10人のユーザーの方々に取扱説明書を与えずに使っていただいて、7人の方までが直感に使えたら例えば合格とするなど(7人で適切かどうか今仮に言っている)、どれくらいの方が直感的に使えるかっていうような試験も実施するべきなのだ。
使用エラーの可能性を減少させなければならない、例えば先ほど述べたように、病人の方、老人の方、妊産婦の方、女性の方、子供などが使った時にも使用エラーが起きないような設計にしなければならないということだ。
ユーザーインターフェース設計の欠陥は使用エラーをもたらし、結果的に患者の負傷や死亡に至ることがあるので、ユーザビリティエンジニアリングを用いて使用エラーを評価してリスクを低減した設計開発が必要であるということを申し上げたい。
製品の使用条件とリスクアセスメントの範囲
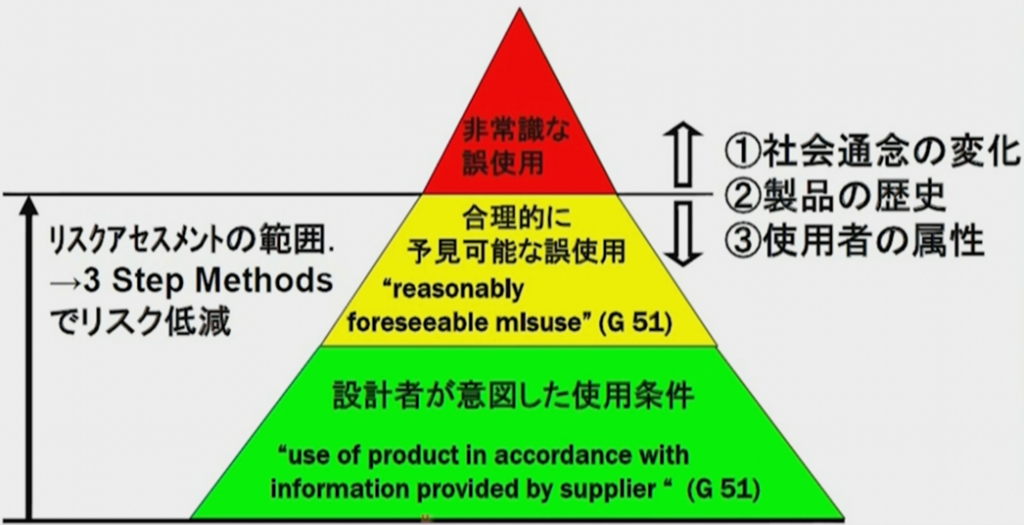
安全性について最後にリスクマネジメントの範囲について述べたい。
かつては設計者が意図した仕様条件、これに基づいて安全設計をしておれば良かったのだが、ISO/IEC共通ガイド51の2014年版以降は、合理的に予見可能な誤使用まで製造者の責任に含められた。
例えば以前は、「それは仕様ですと、そのユーザーさんの使用方法の間違いです。」で済んだのだが、今はそういう使い勝手が悪い機器、使用エラーが起きるような医療機器の設計も製造者の責任なった。
一方で図の一番上、非常識な誤使用、これは設計の範囲ではない。
例えば注射針を振り回して人を怪我させるなどは、とても考えられない非常識な誤使用なので、そういうものは防げない。
誤使用・不注意事故とヒューマンエラー
ただしここで一つ重要なことを申し上げたい。
この、どこまでが合理的に予見可能な誤使用で、どこからが非常識な誤使用かというこの境は、社会通念の変化や製品の歴史など、使用者の属性によって変わる。これが厄介なのである。
例えば有名な話だが、アメリカで猫をリンスした後に寒かろうといって電子レンジに入れた少女がいた話。製造者は、まさか生き物を電子レンジ入れるとは思っていなかった。
しかし、生き物を入れた少女が出たことによって、合理的に予見可能な誤使用の中に入ってしまったというわけだ。
このように、社会通念が変化してもリスクは異なるし、製品の歴史が長くなってもリスクは異なる。
それから使用者の属性、医療関係者のような訓練を受けた方が使う場合もあれば、一般の患者が使う場合もある。前述のように子供が使う場合もある。
使用者の属性によっても設計する安全の度合いというのは異なるのである。
誤使用とか不注意事故の防止というのは喫緊の課題で、ヒューマンエラーがその背景にはある
ヒューマンエラーというのは一定の確率で必ず発生するので、そういった観点でも安全設計が求められる。
お役立ち動画
医療機器の設計・開発・申請における規制要件入門
~品質、有効性及び安全性の確保~
▶ 1講 医療機器と規制要件
▶ 2講 医療機器の種類
▶ 3講 医療機器と品質
▶ 4講 医療機器と安全性
▶ 5講 医療機器と有効性
▶ 6講 医療機器申請と当局査察
関連商品
[blogcard url=”https://ecompliance.co.jp/SHOP/QMS-LIVE.html” title=”【VOD】(全16講)医療機器QMS規制入門セミナー【一括受講コース】” content=”医療機器企業に初めて入社・転職した人向けの規制要件入門コースです。QMSを中心に解説を行います。本邦では、医療機器企業(製造販売業)においては、QMS省令(体制省令)およびGVP省令に則った体制の構築が出来ていなければなりません。
またQMS省令に従って、QMS(Quality Management System:品質管理システム)が文書化されており、適切にQMSに従って運用されており、それら活動の記録が作成されていなければなりません。
QMS省令は、ISO 13485をもとに作成されています。
ISO 13485は、マネジメント(経営者)の責任・リソース(資源)の配分(Plan)、製品実現(Do)、監視測定(Check)、改善(Action)といったPDCAサイクルで構成されています。
PDCAサイクルがあるということは、品質保証システムがあるということで、「今日」よりも「明日」、「明日」よりも「明後日」の方が品質が向上していくという証明となります。
規制当局は「継続的な改善」を求めています。
日進月歩の医療機器においては、常に設計変更が求められ、品質の改善も求められています。
本講座は16講(2時間/講)にわたって、医療機器業界にけるQMSに関する規制要件の内容を初心者にとって分かりやすく、丁寧に解説いたします。”]
[blogcard url=”https://ecompliance.co.jp/SHOP/QMS-MHLW-00.html” title=”【2021年度改正QMS省令対応】QMSひな形一式” content=”厚生労働省は、2021年3月26日付で「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令の一部を改正する省令」(令和3年厚生労働省令第60号)を公布しました。経過措置期間は 3年間であり、2024年3月26日(改正省令の施行の日から起算して3年を経過する日)には新QMS省令を遵守しなければなりません。
今回の改正の趣旨は、QMS省令と医療機器の品質マネジメントシステムの国際規格であるISO13485:2016と整合を図ることです。
改正前のQMS省令はISO13485:2003年版と整合させており、最新の国際規格からは遅れていました。
厚生労働省は、2021年3月26日付で新QMS省令に関する逐条解説も公表しています。 「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令の一部改正について」(薬生発0326第10 号)
イーコンプライアンスでは、下記のお役立ち資料を作成し配布しております。
・改正QMS省令(本文)
・改正QMS省令と現行のQMS省令の対比表
・改正QMS省令逐条解説
・品質マニュアル(QMS省令2021年版対応)
・改正QMS省令手順化要求差異配布
・製品標準書新旧対応表配布
ご希望の方はこちらからダウンロードをお願いいたします。
すでに現行QMS省令に準拠したQMSを構築されている方で、改正対応が必要な方
これから医療機器に参入する方
にオススメのひな形セットです。”]
[blogcard url=https://xn--2lwu4a.jp/qms-md/ title=”QMS(手順書)ひな形 医療機器関連” ]
]]>

Comment