FDAは、2016年2月3日に「Applying Human Factors and Usability Engineering to Medical Devices」と呼ばれるガイダンスを発行した。
このガイダンスは、2000年7月18日付「Medical Device Use-Safety: Incorporating Human Factors Engineering into Risk Management」を置き換えるものである。
実はFDAは以前からユーザビリティという用語を使用せず、ヒューマンファクターという用語を使用してきた。
なぜならば、ユーザビリティという用語は「使いやすさ」を想像させるためである。
FDAが要求するのは「使いやすさ」ではなく「安全性」である。
わざと使いにくくすることもユーザビリティにとっては重要である。
例えば、最近の使い捨てライターはノックが重くなっている。
これは想像の通り、小さな子供たちが火をつけて火事を起こさないためのユーザビリティである。
医療機器の事故は、ユーザの意図した利用(Intended Use)と設計者の設計思想のギャップによって生じるとされている。
医療機器設計がユーザ要求に始まり、設計バリデーションをユーザ環境でユーザが実施しなければならないとされているのはそのためである。
医療機器の設計バリデーションにおいて、ユーザビリティ試験は重要である。
FDAは申請前にユーザビリティ試験のプロトコールを相談するよう求めている。
ユーザビリティ試験では、例えば10人の被験者に取扱説明書を渡さずに何名が直感的に操作できたかを試すこともある。
しかしながらその評価は難しい、10人中7名が操作できれば合格とか、その閾値の設定根拠は説明が困難であるためである。
ユーザビリティでもう一つ重要なことは、使用者と使用環境である。
使用者が医師・看護師である場合もあれば、自宅で子供が使用する場合だって考えられる。
また使用環境も医療機関や検査室の実とは限らない。
AED(自動体外式除細動器)などは、ひょっとすると駅のコンコースで雑踏の中、素人が初めて使用するかも知れない。
雑音で音が聞こえにくい場合もあるだろう、また救急車の中など、振動が激しい環境で使用することもあるだろう。
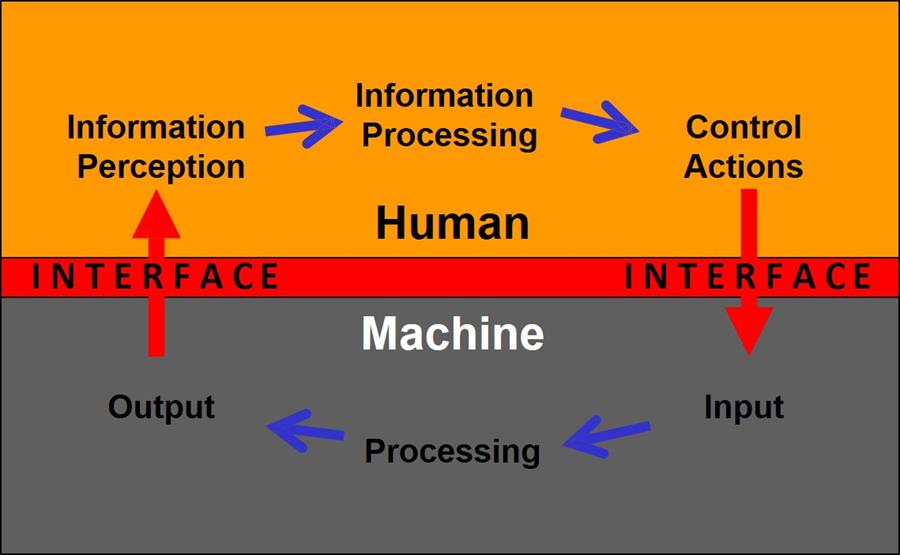
ユーザビリティで問題となるのは、医療機器と使用者のインターフェースである。
図はユーザと機器、それぞれ実施されるプロセスおよびプロセス間のユーザ・インタフェースとのインタラクションのモデルを表している。
ユーザが医療機器を操作するとき、ユーザは機器から出される情報を認識し、それを解釈し、情報を処理し、決定を行う。
ユーザは操作のある局面を変更するために、医療機器に対して応答する(設定の変更、コンポーネントの置換、機器の停止など)。
機器はユーザ入力を受信し、応答し、ユーザにフィードバックする。
ユーザはフィードバックを検討し、インタラクションの追加サイクルを起動するかも知れない。
以前までは医療機器のリスクマネジメントは、取扱説明書に従って使用することを前提としていた。
しかしながら2014年のIEC/ISO 51の改定より、「合理的に予見可能な誤使用」もリスクマネジメントに含めることとなった。
医療機器設計においては、ユーザが犯しやすい誤使用も考慮しなければならない。



Comment