
「GMP施行通知」改定のインパクトを研究するページです。
「GMP施行通知」改定のインパクトを研究するページです。…
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
ICH-Q9において、リスクは「危害の発生の確率とそれが発生したときの重大性の組合せ」との定義されている。これは国際規格であるISOとIECの共通規格としてGuide 51で定義されているものをそのまま採用している。
われわれは普段の生活の中で常にこの掛け算を実施している。
例えば出張で飛行機を利用しようとしよう。誰もが飛行機が墜落をすれば破局的である(重大性=大)ということが理解している。しかしながらおそらく飛行機が墜落することがない(発生確率=極少)と考えている。このように我々は常に頭の中で重大性と発生確率をかけてリスクを判断している。
医薬品におけるリスクにおいて重要な事は、リスクとは必ず患者や消費者への健康被害を対象としなければならない。製品品質に何らかの結果が生じた医薬品が患者に服薬された際にどのような健康被害生じるかを管理する必要がある。
また大事なことは、リスクは決して試すことができないということである。例えば製品に異物を混入させてどの様な健康被害が生じるかを実験するといったことが許されないのである。
理解しておかなければならないことは、構造設備は必ず故障するのである。また人は必ず失敗するのである。
品質リスクマネジメントにおいて重要なことは、構造設備が故障する確率を下げることである。 また万が一故障した場合にそれを発見する確率を高めることである。
同様に、ヒューマンエラーを起こす確率を下げること及び発見確率を高めなければならない。
筆者は、長年にわたって製薬企業や医療機器企業においてリスクマネジメントに関するコンサルテーションを実施してきた経験を持つ。
多くの企業ではリスクマネジメントの本質を理解していないことが多い。
PMDAのホームページに「医薬品製造所における品質マネジメントシステムの活用及び医薬品品質システムの取り組みに関する研究」における成果物が公開されている。
これらは『本研究は、医薬品品質システム及びその活動の実現のための重要な要素である品質リスクマネジメントの考え方を国内の製造所に広く導入する仕組みを提案することを目的とした』ものであるという。
この中で、品質リスクマネジメントの活用を促進させるためのツールとしてリスクアセスメントシートがある。その内容をみて筆者は驚愕した。
このリスクアセスメントシートには、数多くのリスク事例が掲載されている。しかしである。多くがリスクマネジメントにとって不適切であると言わざるを得ない。
例えば「ユーザー要求仕様書(URS)を作成していない」や、「 DQを実施していない」などが例として挙げられている。
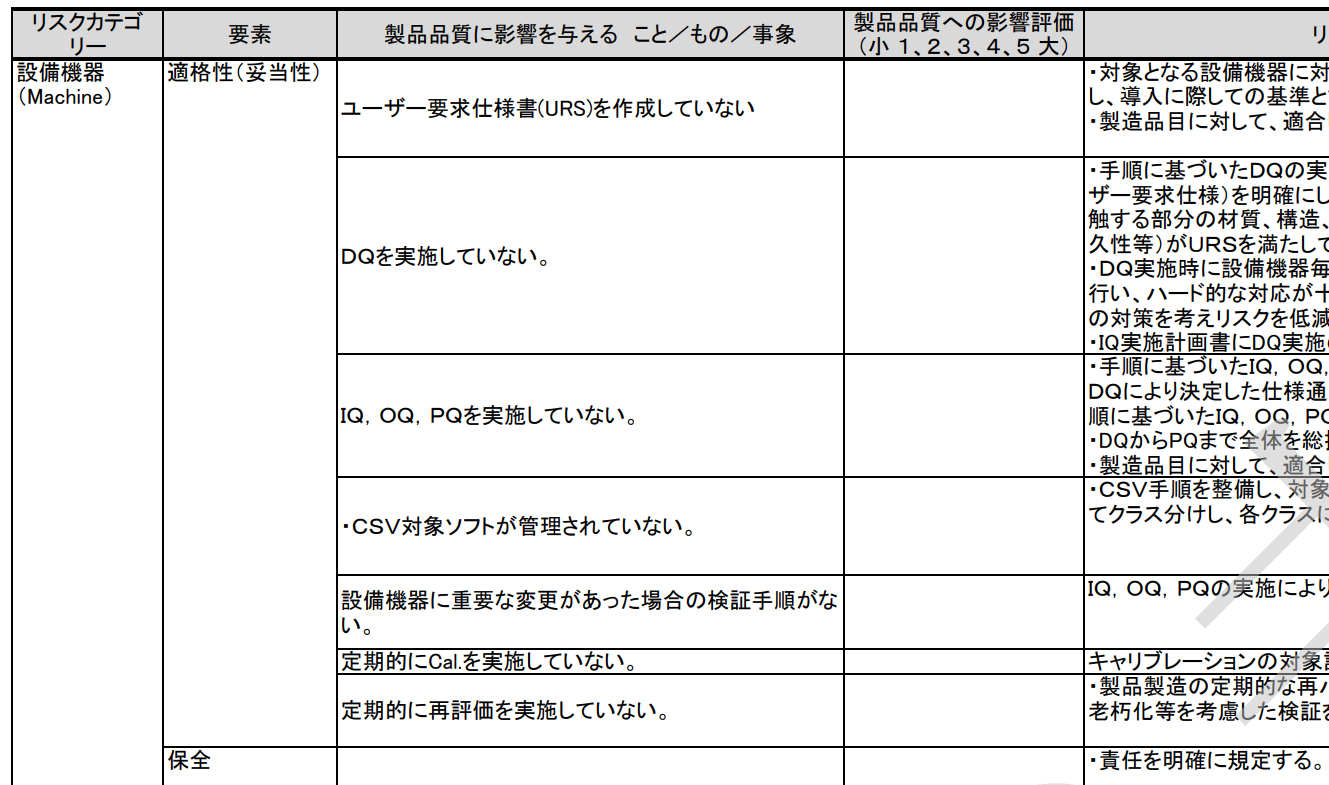
これらはいわば不作為である。ユーザー要求仕様書を作成することやDQを実施することは必須である。
それらが実施されていないことをリスクとすることは極めて不適切である。規制要件やSOPを遵守し作業を実施することは当然のことである。
またこのリスクアセスメントシートには、重大性、発生確率、検出確率を記載する欄がない。
本来リスクアセスメントシートには、当該の構造設備においてどのような故障や操作上のミスが発生するかを列挙なければならない。
そのような故障やミスが発生した場合に製品の品質にどのような影響が生じるかを推定する。またその結果、品質に欠陥をもった医薬品が出荷され、患者が服薬した際にどのような健康被害が生じるのかを評価しなければならない。
品質リスクマネジメントの本質を理解し、適切な実施例を示すことが望まれる。
データインテグリティに関する規程・手順書
イーコンプレスでは「データインテグリティ規程・手順書」の販売を開始いたしました。
データインテグリティ規程・手順書 55,000円(税込)
【目次】
目次
データインテグリティ規程
1. 目的
2. 適用範囲
3. 用語の定義
4. 背景
5. データインテグリティの原則
6. データガバナンス
6.1 データインテグリティのためのステップ
6.1.1 教育およびコミュニケーション
6.1.2 リスクの発見および低減
6.1.3 技術およびITシステム
6.1.4 データガバナンス
7. 手順書等
8. 参考
9. 付則
データインテグリティ手順書
1. 目的
2. 適用範囲
3. 用語の定義
4. 役割と責任
5. 啓発活動
6. 教育訓練
7. 関連する手順書の改訂
7.1 リスクマネジメント
7.1.1 リスクの検討
7.1.2 リスク低減策の検討
7.1.3 リスク低減策の実施
7.2 データライフサイクル
7.2.1 データの作成
7.2.2 データの処理
7.2.3 データのレビュ・報告・使用
7.2.4 データの保管・維持
8. コンピュータシステムの見直し、導入
9. 監視・測定
10. 監視・測定
11. 記録の保管
12. 参考
13. 付則
ご購入は こちら


Comment