製薬企業や医療機器企業は規制要件を遵守する必要がある。
また供給者も同様に規制要件に適合する原料・材料・資材等を製造し、供給する責任がある。
しかしながら、供給者に規制要件を教育し、また要求される品質を担保させることは容易ではない。
企業が作る商品には様々な購買製品が含まれている。購買プロセスは、購買製品の品質を確保するための重要プロセスである。製薬企業や医療機器企業は規制要件を遵守する必要がある。また供給者も同様に規制要件に適合する原料・材料・資材等を製造し、供給する責任がある。しかしながら、供給者に規制要件を教育し、また要求…
製薬企業においては原薬を輸入する際などにリスク管理は必須である。
2008 年には、ヘパリン ナトリウムの副作用により米国で 81 名が死亡した。
その原因は中国の原薬製造メーカーが偽薬を混入したためである。
ヘパリンナトリウムは、抗血液凝固剤として使用される。
もともとは原料を牛の腸の粘膜から採取していたが、BSE問題により豚から採取することに変更となった。
しかし、四川大地震により豚の価格が高騰したため、中国の原薬製造メーカがHPLCのピークがヘパリンナトリウムとよく似た物質を混入させたのである。
事件発覚後、FDA は 原薬を輸出した中国の製薬会社を一度も査察していなかったことが発覚した。
それ以降、FDAは2008年に上海を拠点に中国に4ヶ所の事務所を設置した。
当初はFDAから7人と中国人8名の計15名で中国の製薬企業の監視を始めた。
またインドに関しても同様の監視を行っている。
現在では、米国外では珍しい非通知査察(事前の予告をしないで査察が実施される)が実施されている。
購買プロセス概略

一般的に購買プロセスは図のように進められる。
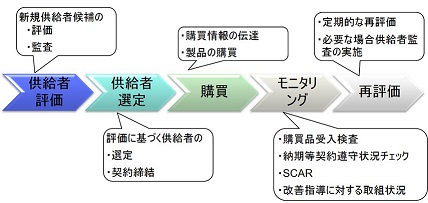
1.供給者評価では、新規供給者候補の評価を実施する。また必要に応じて監査を実施する。
2.供給者選定では、評価に基づく供給者の選定を行い、契約を締結する。
3.購買では、購買情報を伝達し、製品の購買を実施する。
4.モニタリングでは、購買品の受入検査を実施する。品質問題があった場合にはSCAR(Supplier Corrective Action Request:供給者改善要求書)を発行し、品質改善を要求する。改善指導に対する取組状況もモニタリングする必要がある。
また必要に応じて納期等の契約事項が遵守されているかなど状況をチェックする。
5.再評価では、定期的に供給業者を再評価し、見直しを実施する。必要な場合は、供給者監査を実施する。
供給者の評価について
供給者評価・監査の結果に基づき、適切な供給者を選定しなければならない。
多くの企業では供給者評価表を作成しているものと思われる。
供給者評価では、少なくともQCD(Quality:Cost:Delivery)をチェックしなければならない。
Qualityは品質である。当該供給者が品質システム(QMS:品質マネジメントシステム)を構築しており、適切な記録が残されているかどうかを評価する。
またすでに納入実績がある供給業者の場合は、これまでの受入試験の結果を評価に加える。
Costは価格である。一般に品質と価格は比例する。良い品質のものは価格が高くなる傾向にある。しかしながら、出来る限りコストは抑えなければならない。
Deliveryは納期である。品質とコストが要求通りであったとしても納期に間に合わなければ問題が発生する。
大事なことは、Q・C・Dのバランスである。
筆者が監査した企業では、Q・C・Dの評価を合計し、基準を超えれば合格としている場合が少なからずある。
例えば、品質が悪くとも、コストが安く納期が遵守できれば合格となってしまう。これでは意味がない。
本来はQ・C・Dともに基準を超えている必要がある。
Q(品質)とC(コスト)とD(納期)を合計するというのは、身長と体重と血圧を合計していることに等しい。


Comment