一般に機器設計においては、機能要求と性能要求をもとにする。しかしながら、医療機器の設計においては安全要求も追加しなければならない。…
ユーザである医療関係者(医師、歯科医師、看護師、検査技師等)や患者からユーザ要求を収集した際、機能要求や性能要求のみである場合が大半である。ほとんどの場合、安全要求はユーザや患者から得ることはできないのである。
医療機器には何らかのリスク(危害の潜在的な源)が存在している。何らかのリスクを抱えた状態で市場へ出荷され、事故が起る前に予防策として、あらゆるリスクを検出し、それによって患者やユーザに危害を及ぼさないようにすることが必要となる。
そもそも「安全」というものは存在しない。あるものはリスクのみである。つまりリスクの存在しない製品(リスクフリー:ゼロリスク)などないのである。エレベータだって、エスカレーターだって、自動車だって、車椅子だって必ずリスクが存在するのである。
必要なことは、あらかじめ想定されるリスクを推定し、すべてのリスクについて受容可能なまで低減を図ることである。リスク分析は医療機器設計開始前までに終了させておかなければならない。
リスクコントロール(安全策)の構築後にも残るリスクのことを残留リスク(residual risk)と呼ぶ。医療機器設計においてはこの残留リスクに注目しなければならない。もし残留リスクが受容可能性を超えている場合、リスク/便益分析を実施しなければならない。つまり便益(ベネフィット)がリスクを上回る場合に限って、医療機器の設計を進めることができる。
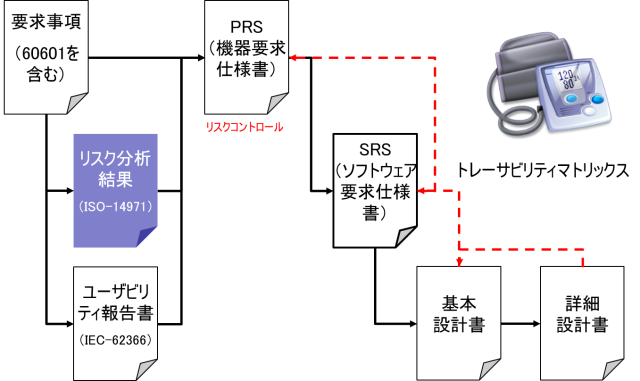
前述の通り、ユーザや患者は安全要求を述べることは少ないだろう。そこで、機器要求仕様書(PRS:Product Requirements Specification)においては、安全規格の要求を追記しておかなければならない。
医用電気機器(ME機器:Medical Engineering機器)の場合は、IEC-60601-1等の要求事項を追記しなければならない。安全規格に従って医用電気機器を設計した場合、基礎安全(BASIC SAFETY)と呼ばれる、ME機器を正常状態および単一故障状態で使用するとき、物理的ハザードに直接起因する受容できないリスクがない状態となる。
言わば安全規格は先人の知恵であり、過去の悪しき轍(事故経験)を踏まないために存在するのである。
筆者がリスクマネジメントに関するコンサルテーションを実施する際に、多くの医療機器企業で、リスク分析(リスクマネジメントワークシート)のハザード欄に電磁波をあげているケースがある。
しかしである。電磁波はIEC 60601-1-2で規格が決められている。つまり、医療機器企業においてリスク分析をするまでもなく、すでに要求事項なのである。
リスク分析(リスクマネジメントワークシート)に安全規格で要求されている事項ばかりを記載しているケースが多いが、これは間違いである。
リスクマネジメントにおいては、安全規格には記載のない、当該機器における特性・特質(つまり差分)についてハザードを抽出する必要がある。
さらに最近では、ユーザビリティに関する要求(例:IEC-62366)が厳しくなってきた。ユーザビリティと聞くと「使いやすさ」を想像しがちであるがそうではない。例えば、使い捨てライターのノックを重く(固く)しているのは、子供がいたずらをして火事を起こさないためなどである。
ユーザビリティエンジニアリングは、ヒューマンエラー(ユーザインターフェース)に特化したリスクマネジメントである。医療機器が高度化、複雑化、多様化、高速度化するにつれて、ヒューマンエラーの発生確率とその重大性が増してきている。
医療機器においてはヒューマンエラーの回避は喫緊の課題である。
ユーザビリティエンジニアリングの結果も機器要求仕様書(PRS)に含められなければならない。
リスクマネジメントにおいて重要なことは、リスクの発生確率を下げることである。一般にリスクの重大性を下げることは困難である。例えば、墜落しても乗客・乗員が死亡しない飛行機は設計できないのであって、極めて墜落しない飛行機(発生確率≒0)は設計できるのである。
やはり筆者が経験する事例として、そもそも発生確率の極めて低いリスクシナリオをリスク分析(リスクマネジメントワークシート)に記載していることが多々存在する。
例えば「手術中に患者がベットから落下して死亡する」などである。はたしてこのような事態が想定されるであろうか。また万が一想定されるとしたら、どうやって設計でコントロールできるのであろうか。いったい過去にベットから患者が落下した事故が、どれくらいの確率で発生しているのだろうか。
医療機器のリスクマネジメントでは、市場からの製品(類似製品を含む)に対するフィードバック情報も重要な要素となる。この活動はPDCAを基本としている。
残念ながら医療機器におけるリスクマネジメントを正しく理解している企業は多くない。これでは、患者やユーザの安全は担保できない。
【お知らせ】
イーコンプライアンスでは、ISO-14971:2019対応QMSひな形を販売しております。
リスクマネジメント規程・手順書・様式
また各種QMSのひな形を販売しております。詳細はこちら
関連商品

医療機器業界では、欧州が先行し、90年代からIOS-14971が制定されました。
医療機器には何がしかのリスクが潜んでいます。リスク分析の結果は、設計管理のインプットとなります。
医療機器事故は、ユーザの意図した利用と設計者の思想のギャップによって起こるとされています。
昨今では、ユーザビリティを含め、合理的な誤使用を予測したリスク分析が求められています。
演者は多くの医療機器企業においてリスクマネジメントの指導を行ってきましたが、各社ともに我流で実施していることが多いようです。
それでは、医療機器の安全が確保できず、また回収(改修)も減少しません。
そのためには、リスクマネジメントの基本的な考え方と規制当局の期待を十分に理解しなければなりません。
本セミナービデオでは、難解なリスクマネジメントを初心者にもわかりやすく解説いたします。”]
[blogcard url=”https://ecompliance.co.jp/SHOP/EL-008.html” title=”【セミナービデオ】医療機器企業におけるリスクマネジメントセミナー” content=”医療機器企業にとって、リスクを管理することは非常に重要です。しかしながら、リスクマネジメントは難解です。医療機器業界では、欧州が先行し、90年代からIOS-14971が制定されました。
医療機器には何がしかのリスクが潜んでいます。リスク分析の結果は、設計管理のインプットとなります。
医療機器事故は、ユーザの意図した利用と設計者の思想のギャップによって起こるとされています。
昨今では、ユーザビリティを含め、合理的な誤使用を予測したリスク分析が求められています。
演者は多くの医療機器企業においてリスクマネジメントの指導を行ってきましたが、各社ともに我流で実施していることが多いようです。
それでは、医療機器の安全が確保できず、また回収(改修)も減少しません。
そのためには、リスクマネジメントの基本的な考え方と規制当局の期待を十分に理解しなければなりません。
本セミナービデオでは、難解なリスクマネジメントを初心者にもわかりやすく解説いたします。”]
[blogcard url=”https://ecompliance.co.jp/SHOP/MD-QMS-026.html” title=”【ISO 14971:2019対応】リスクマネジメント規程・手順書・様式” content=”ISO14971:2019に沿った形のリスクマネジメント規程・手順書・様式です。医療機器設計におけるリスク分析は、ISO-14971に従って実施されています。
リスクマネジメント実施のための手順や様式を整えておかなければなりません。”] ]]>


I’m truly enjoying the design and layout of your blog.
It’s a very easy on the eyes which makes it much more enjoyable for me
to come here and visit more often. Did you hire out a developer
to create your theme? Great work!
When I initially commented I clicked the “Notify me when new comments are added” checkbox and now each time a comment is
added I get three emails with the same comment. Is there any way you can remove me from that service?
Thanks!