*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
COⅥD-19のパンデミックに関連し、欧州議会(European Parliament)は、欧州医療機器規則(MDR)2017/745の実施を12ヶ月延期するという欧州委員会(European Commission)の提案を採択した。
この提案が正式に発効されるためには、加盟国によって承認され、欧州連合官報(OJEU)で公開する必要がある。遅くとも2020年5月26日までに行われる見込みである。発効されると、MDRの新しい適用日(DoA)は2021年5月26日となる予定である。
DoAは1年延期されるが、NBが発行したMDDに基づく証明書が無効になる期限は2024年5月26日で変わらない。
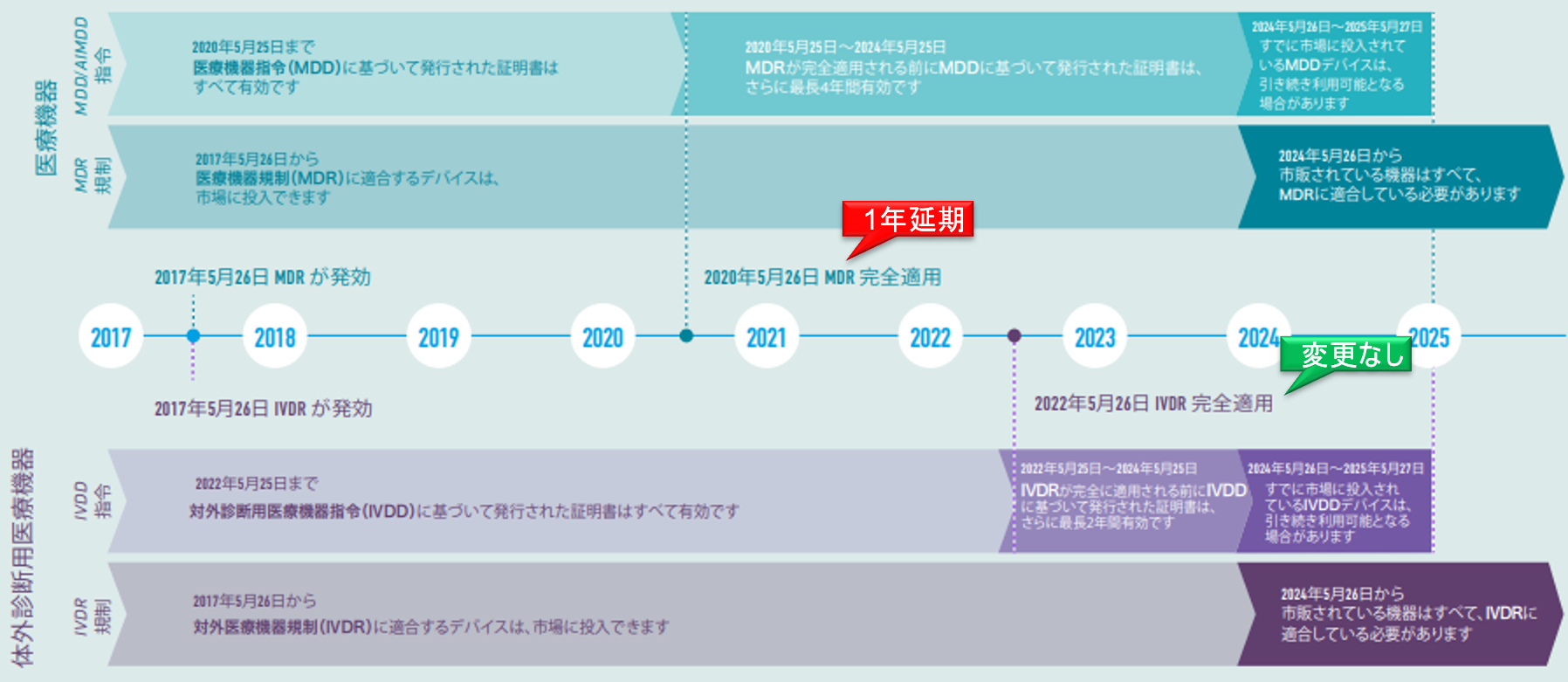
- MDR施行(entry into force)
EU Official Journal掲載(2017年5月5日)の20日後 - MDR適用(application)
2021年5月26日(MDDが無効となり、MDRが適用される。) - クラス分類ごとの移行スケジュール(Article 120)
機器ごとにスケジュールが異なっているが、いずれも既に流通している機器については移行期間が設けられている。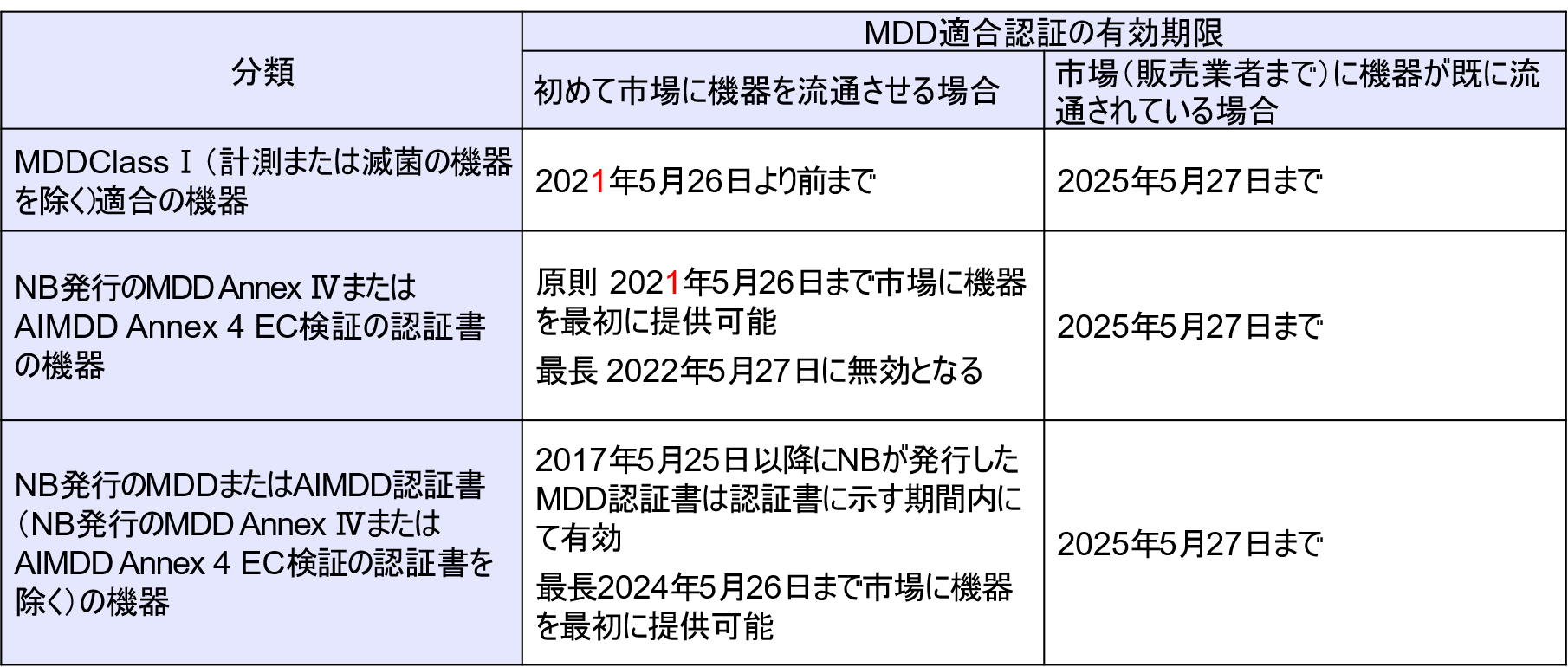
- 2021年5月26日から発行されるNBの認証書は全てMDR適合の認証になるため、NBは、当該日以前からMDDでの審査受付を終了し、MDRでの審査を開始する可能性がある。
NBにMDDでの審査を希望する場合は、審査受付、認証書の再発行はいつまで可能かを確認する必要がある。 - MDDの認証書に基づいてCEマーキングを表示した医療機器が、すでに「Placing on the market」されている場合、最長2025年5月27日まで「Making available on the market」「Putting into service」することができる。
ただし、それ以降は、欧州医療機器指令(MDD)の認証書に基づいてCEマーキングを表示した医療機器は、流通も使用開始もできなくなる。
NBがMDDにもとづいて発行した認証書は、2024年5月27日には全て無効になる。
もし認証書記載の有効期限(発行後5年間)がそれ以前に終了する場合は、有効期限終了まで有効。 - MDD適合認証として2021年5月26日以降も機器を市場等に流通させる場合、当該機器は、MDDに適合し続け(認証したNBのサーベイランスの実施を含む)、設計および意図した目的に重大な変更を行わない必要がある。
MDDの認証書に基づいてCEマーキングを表示した医療機器は、認証書の有効期間中(遅くとも2024年5月26日まで)、機器の意図された使用と設計に重大な変更(Significant Change)がない場合のみ「Placing on the market」を続けることができる。 - 適用日からはMDRのEU認証書を取得していなくても、要求事項によりMDRに基づいた監査が開始される。
認証書が有効な期間であっても、適用日以降は、市販後調査(PMS)、市場監視、市販後監視(Vigilance)、事業者および機器の登録の要求事項についてはMDRに規定に従わなければならない。(Article 120 第3項) - MDRへの適合認証は2017年5月25日より可能。そのため、当該機器は2021年5月26日より前に市場に機器の提供を開始できる。
- NBによるMDR認証が必要となるClassⅠ(計測、滅菌、再使用可能な外科用器具・機器)、Ⅱa、Ⅱb、Ⅲ 機器は、NBによるMDR認証の審査が可能となった時に審査され、MDR認証書が発行される。
一部のClassⅡbおよびⅢの機器は、臨床評価報告書(Clinical Evaluation Report)の審査をNB以外の専門委員会(Expert Panel)等で実施される。 - 複数の審査機関が関与する機器の場合、体制が整っていないと審査ができない可能性がある。そのため、審査体制の整備状況の確認が必要となる。
- NBはMDRの適合性評価機関となるための申請を2017年11月26日より実施しているが、NBがMDRの適合性評価機関として認可されるまで時間が必要。
- 有効なQMSが必要であることに留意すること。
MDRは製造業者が有効なQMSがあることを示すことを求めている。
QMSの移行スケジュールは記載されていないが、認証書が切れた場合、有効とならない可能性がある。
ClassⅠ機器
- NBによる認証が不要な(認証書がない) ClassⅠ機器
2021年5月26日より前に市場に出荷(Placing on the market)した機器は、2025年5月26日まで市場で入手可能(Making available on the market)または使用開始(Putting Into service)しても良い。 - MDRからNB関与となるClassⅠ機器(認証書がないClassⅠ医療機器のうち特に再使用可能外科用器具)は、 2021年5月26日までにMDDへの適合宣言書が作成されていれば2024年5月26日まで市場に出荷(Placing on the market)または使用開始(Putting Into service)しても良い。
- ClassⅠ機器(計測または滅菌の機器を除く)で、初めて市場に機器を出す場合は、2021年5月26日からMDRに切り替えを求められる。
- 再使用可能な外科用器具(ClassⅠ)については、第2回修正表で特別扱いするためのルールが示されている。
- ClassⅠ機器で、以下の5条件を満たす場合は、2024年5月26日までEU市場にPlace on the marketできる。
- MDD(93/42/EEC)へ適合した機器。
- MDR においてNBの関与が必要となる。
- 測定機能付き機器、滅菌機器以外のClassⅠ機器であって、2021年5月26日より前にMDD Annex Ⅻに基づいた適合宣言が実施されている。
- 2021年5月26日より後は、設計および意図した使用についての重大な変更(Significant Change)を実施しない。
- 市販後監視、市場監視、ビジランス、経済事業者(Economic operators)および機器の登録に関わる要求事項は、2021年5月26日から MDRの要求事項が適用される。
UDI(Unique Device Identification)の移行スケジュール
市販後、医療機関を含む市場でのトレーサビリティ・トラッキングを強化するため、機器ごとにUDI 番号およびバーコード等を貼付することが、MDRの要件として追加されている。
正式なUDIに関わるコードを発行する機関は欧州委員会によって指定される。
正式なコード発行機関が指定されるまでは、2019年5月26日からGS1コード、医療産業ビジネス協議会(HIBC)、血液関係製品自動化・共有化国際協議会(ICCBBA)のいずれかの機関より発行されたコードが使用可能としている(Article 123(3)(i))。
UDIはEUDAMEDに登録する必要がある。(登録はEUDAMEDの進展次第)
埋込機器の場合、UDIの適用に関わらず、Article 18に適合するインプラントカードを必要とする。
UDIの梱包への表示の移行措置終了(強制化)は以下の通り。
- Class Ⅲおよび埋め込み医療機器は2021年5月26日
- Class ⅡaおよびClassⅡb医療機器は2023年5月26日
- ClassⅠ医療機器は2025年5月26日
- それぞれの医療機器本体への表示の強制化は、梱包への表示の2年後
機器のラベルおよび包装(輸送包装を含まない)のUDI貼付の適用日(該当機器はUDIが通関時には貼付されている必要がある)は以下の通り。(Article 123(f))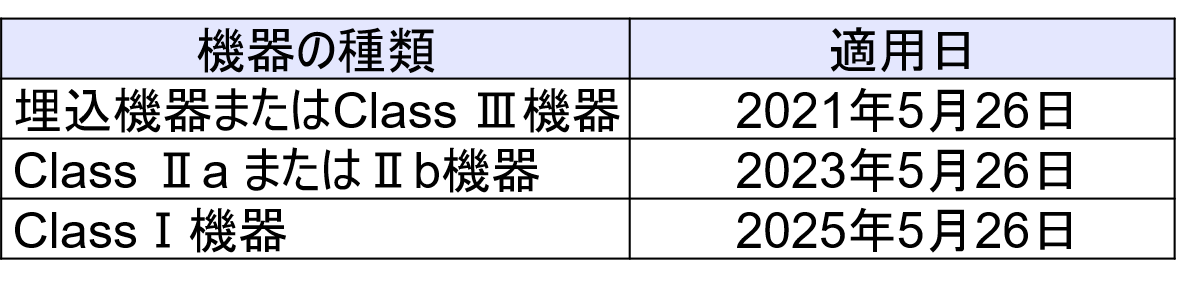
EUDAMED(European Database on Medical Devices)
EUDAMEDは、事業者、機器、認証、臨床試験、市販後監視情報、UDI等の様々な登録および情報の検索ができるデータベースである。
MDDのデータベースは、規制当局内のみの取り扱いで非公開であったが、MDRでは一般公開の予定となっている。データベースが公開されれば、製造業者は規則対応の参考にできると予想される。
EUDAMEDは2020年5月26日までに稼働することを目指している。
しかし、もし2020年5月26日にEUDAMEDが完全に機能していない場合は、EUDAMED稼働に関する通知が発行された6ヶ月後に適用される。(Article 34、123(d))。
EUDAMEDが機能するまでは、前述のUDIのような登録に関わる要求事項は適用されないとされているが、今後の進捗を確認していく必要がある。
なお、UDI および認証書のEUDAMED登録は、EUDAMEDが機能した日から18ヶ月後に適用とされている(Article 123(e))。



Comment