From QSR to QMSR
On February 23, 2022, the FDA published a proposal to amend the current QSR (Quality System Regulations: 21CFR Part 820 Quality System Regulations) to align with ISO 13485:2016.
The regulations that align QSR with ISO 13485:2016 are called Quality Management System Regulations / QMSR.
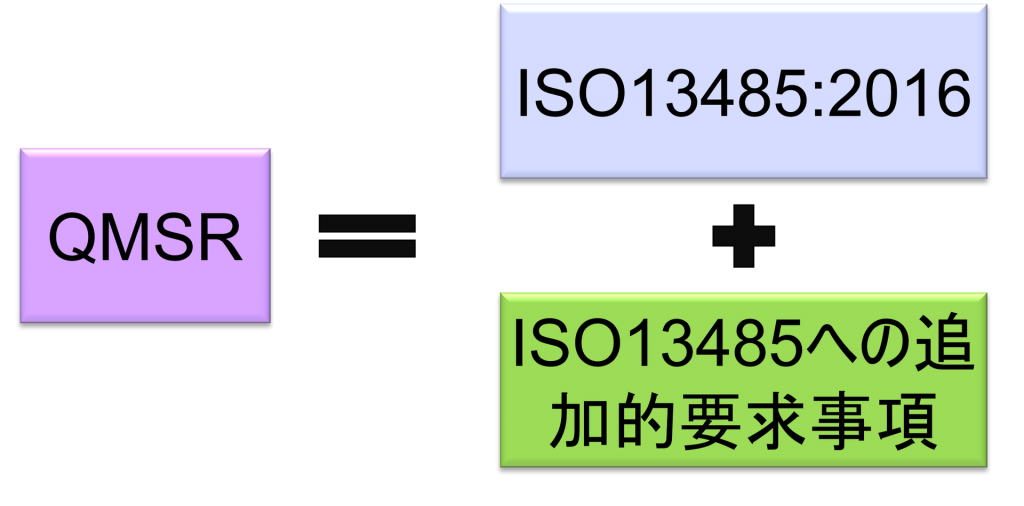
The QMSR will align many of its requirements with ISO 13485:2016 by incorporating the requirements of ISO 13485:2016.
On the other hand, it adds additional requirements to ISO 13485:2016 regarding the retention of complaint files and other records.
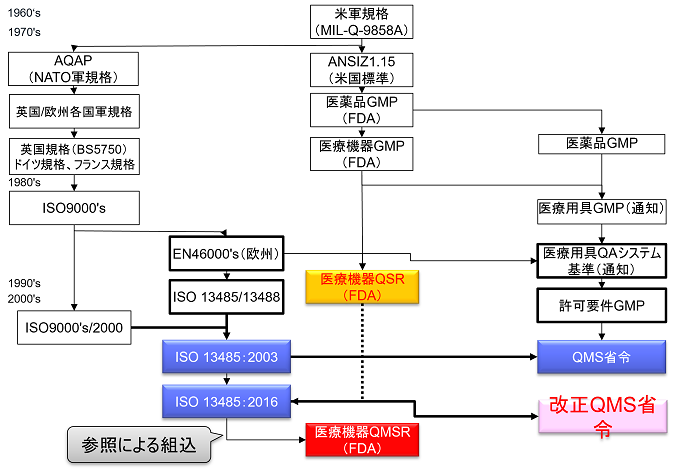
The QSR has served as the medical device quality system regulation in the United States for more than 20 years since the current rule went into effect on October 7, 1996.
To date, the QSR has never been revised, although minor revisions have been made.
For this revision from QSR to QMSR, FDA intends to consolidate the requirements in the U.S. and the quality management system requirements used by other regulatory authorities.
Key Points of Revision
In Part 820, FDA seeks to align with QMS requirements used by other regulators by incorporating ISO 13485:2016 by reference.
This amendment changes the title of the Part 820 regulations from Quality System Regulations (QSR) to Quality Management System Regulations (QMSR).
In principle, the QMSR will withdraw the current Part 820 QSR requirements and adopt the ISO 13485:2016 requirements; the QMSR is not changing the ISO 13485:2016 requirements themselves.
While Japan incorporates ISO 13485:2016 requirements in the main body of the QMS Ministerial Ordinance (Chapter 2) and specifies additional Japanese requirements in Chapter 3, the QMSR does not incorporate ISO 13485:2016, but takes the form of a reference.
However, some definitions in the current QSRs will be retained or retained with changes. In other words, the requirements in the QSR, but not in ISO 13485:2016, are specified in the QMSR. (The requirements of ISO 13485:2016 are accepted as is, with FDA’s own requirements added.)
FDA-specific requirements and provisions will also be added to clarify certain concepts used in ISO 13485:2016.
The requirements of the QMSR are virtually identical to those of the QSR
The requirements of the current Part 820 (QSR) are substantially the same as those of ISO 13485:2016 as a whole. Thus, the requirements of the QMSR are virtually identical to those of the QSR, as the requirements specific to the QSR are retained in the QMSR.
Key Point 1: The requirements of the QMSR are virtually identical to those of the QSR.
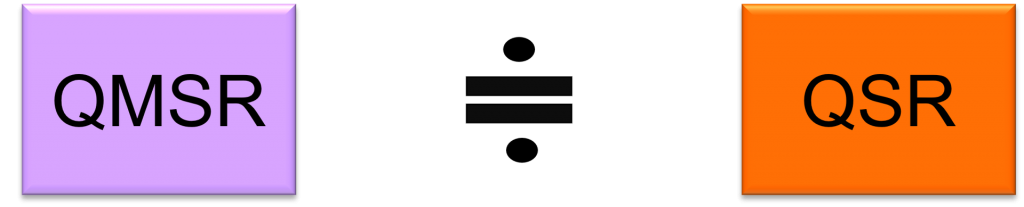
Key Point 3. designed to lead to compliance with QMSR = compliance with ISO 13485:2016.
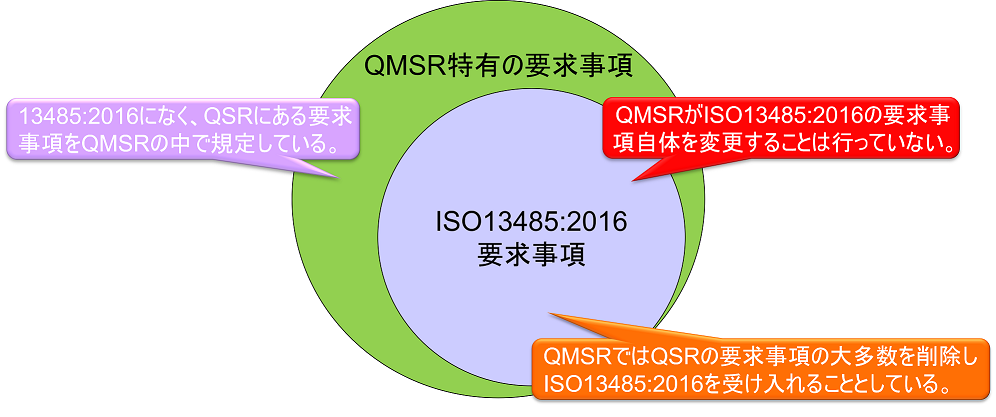
Additional requirements for ISO 13485
In the diagram above, the QMSR-specific requirements are as follows
1.Requirements for records (§ 820.35)
- Signature of the person approving the record and the date of approval
- Records of complaints
- Records related to ancillary services
- Records related to UDI
- Handling of Confidential Records
2.Labeling and packaging requirements (§820.45)
3.UDI (see §820.10 through Part 830)
4.Traceability (see §820.10 through Part 821)
5.Adverse event reporting (see §820.10 through Part 803)
6.Recovery (see § 820.10 through Part 806)
The following record components are not specified in the QMSR as they can be accomplished by following the provisions of ISO 13485
- Design History File (DHF) (currently 820.30(j))
- Machine original book (DMR) (now 820.181)
- Equipment History Register (DHR) (now 820.184)
- Quality System Records (QSR) (currently 820.186), etc.
Relationship between ISO 13485 certification and FDA inspections after adoption of QMSR
After the QMSR is finalized, the Quality System Inspection Technique (QSIT) will be reviewed.
An ISO 13485 certificate will not be issued as a result of an FDA inspection.
Having an ISO 13485:2016 certificate of conformity does not exempt a company from FDA inspection.
The FDA will not develop an ISO 13485 certification program.
Although the QMSR will incorporate ISO 13485, even if a company has ISO 13485 certification, it will not be granted any kind of burden reduction by the FDA.
related product
[blogcard url=”https://ecompliance.co.jp/SHOP/O094.html” title=”【VOD】QMSRセミナー (Quality Management System Regulation)”content=”2022年2月23日、FDAは現行のQSR(品質システム規制:21CFR Part 820 Quality System Regulations)をISO 13485:2016に整合させる改正案を公表しました。
QSRは1996年10月7日に現行の規則が発効されて以降、20年以上に渡り米国における医療機器品質システム規制として機能してきたものです。
これまでの間、QSRは軽微な修正はあったものの、改定は一度も実施されてきませんでした。
FDAがQSRによる規制を実施する一方で、品質システム規制に対する当局の期待は時代とともに変化し続けてきました。
日本や欧州、カナダといった多くの国の規制当局は、医療機器の品質システムに関するマネジメント規格であるISO 13485を品質システム規制として取り入れています。
FDAも、他国の規制当局との調和の利点を認識しており、MDSAPへの参加等、規制のハーモナイゼーション活動に取り組んできました。
そして今般、医療機器品質システム規制の国際整合を目指し、QSRのISO13485:2016への調和を目指すこととなりました。
QSRをISO 13485:2016と整合させる規制は「Quality Management System Regulations / QMSR」(品質マネジメントシステム規制)と呼ばれます。
QMSRはISO 13485:2016の要求事項を組み込むことにより、ISO 13485:2016と多くの要求を整合さる予定です。
その一方で、苦情ファイル等の記録の保持に関してISO 13485:2016に追加的要求事項を上乗せしています。
本セミナーでは、QMSRにおける改正点のみではなく、QMSR全般について詳しくわかりやすく解説します。
また、QMSRの要求事項およびISO 13485:2016との差異、QMSRの要求事項を満たすQMS構築について解説します。”]
QSRは1996年10月7日に現行の規則が発効されて以降、20年以上に渡り米国における医療機器品質システム規制として機能してきたものです。
これまでの間、QSRは軽微な修正はあったものの、改定は一度も実施されてきませんでした。
FDAがQSRによる規制を実施する一方で、品質システム規制に対する当局の期待は時代とともに変化し続けてきました。
日本や欧州、カナダといった多くの国の規制当局は、医療機器の品質システムに関するマネジメント規格であるISO 13485を品質システム規制として取り入れています。
FDAも、他国の規制当局との調和の利点を認識しており、MDSAPへの参加等、規制のハーモナイゼーション活動に取り組んできました。
そして今般、医療機器品質システム規制の国際整合を目指し、QSRのISO13485:2016への調和を目指すこととなりました。
QSRをISO 13485:2016と整合させる規制は「Quality Management System Regulations / QMSR」(品質マネジメントシステム規制)と呼ばれます。
QMSRはISO 13485:2016の要求事項を組み込むことにより、ISO 13485:2016と多くの要求を整合さる予定です。
その一方で、苦情ファイル等の記録の保持に関してISO 13485:2016に追加的要求事項を上乗せしています。
本セミナーでは、QMSRにおける改正点のみではなく、QMSR全般について詳しくわかりやすく解説します。
また、QMSRの要求事項およびISO 13485:2016との差異、QMSRの要求事項を満たすQMS構築について解説します。”]
content=”ISO-13485:2016に沿った形の品質マニュアル(ひな形)です。
多くの医療機器企業では、ISO-9001やISO-13485に沿った品質マニュアルを作成していますが、ISO-13485認証審査対応のためには、QSR(品質システム規則:21 CFR 820)に従った品質マニュアルを作成し、説明しなければなりません。
これから作成する医療機器企業様およびISO-13485認証審査を予定している企業様、認証機関から改善指示を受けた企業様向けに、サンプルをご用意いたしました。
MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。”]
]]>


Comment